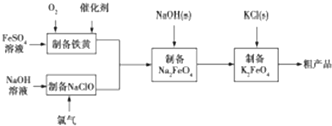
题目内容
13.某次采集酸雨样品,每隔一段时间测定一次pH,得到数据如表:| 时间 | 开始 | 8小时 | 16小时 | 24小时 | 32小时 | 40小时 | 48小时 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
(2)pH变化的离子方程式:2H2SO3+O2=4H++SO42-.
分析 (1)酸雨形成的主要原因是大量燃烧化石燃料,产生二氧化硫,随雨降落形成;
(2)发生的反应为:2H2SO3+O2=2H2SO4,由弱酸生成强酸,酸性增强.
解答 解:(1)酸雨形成的主要原因是:大量燃烧化石燃料(煤和石油等),产生二氧化硫,随雨降落形成,
故答案为:酸雨样品中的H2SO3逐渐被氧化成H2SO4,使溶液的酸性增强;
(2)酸雨样品放置,发生的反应为:2H2SO3+O2=2H2SO4,酸雨样品中的H2SO3逐渐被氧化成H2SO4,使溶液的酸性增强,
故答案为:2H2SO3+O2=4H++SO42-.
点评 本题考查酸雨的形成、硫元素化合物的性质等,比较基础,注意对基础知识的理解掌握.

练习册系列答案
相关题目
1.羰基硫(COS)可用作粮食熏蒸剂,可由CO 与H2S 在一定条件下反应制得.在恒容的密闭容器中发生反应并达到平衡:CO(g)+H2S(g)?COS(g)+H2(g),数据如表所示:
下列说法正确的是( )
| 实验 | 温度/℃ | 起始时 | 平衡时 | |||
| n(CO)/mol | n(H2S)/mol | n(COS)/mol | n(H2)/mol | n(CO)/mol | ||
| 1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
| 2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | a |
| 3 | 400 | 20.0 | 20.0 | 0 | 0 | 16.0 |
| A. | 上述反应是吸热反应 | |
| B. | 实验1 达平衡时,CO 的转化率为70% | |
| C. | 实验2 达平衡时,a<7.0 | |
| D. | 实验3 达平衡后,再充入1.0molH2,K 值增大,平衡逆向移动 |
18.下列物质中,含有氧分子的是( )
| A. | MnO2 | B. | CO2 | C. | H2O2 | D. | 空气 |
2.下列实验操作的描述中,正确的是( )
| A. | 过滤时,慢慢地将液体直接倒入过滤器中 | |
| B. | 在食盐溶液蒸发结晶的过程中,当蒸发皿中出现较多量固体时即停止加热 | |
| C. | 酒精灯不慎碰倒起火时可用水扑灭 | |
| D. | 先在天平两个托盘上各放一张相同质量的纸,再把NaOH固体放在纸上称量 |
3.下列现象是因为发生取代反应的是( )
| A. | 乙烯使酸性KMnO4溶液褪色 | |
| B. | 乙烯使溴水褪色 | |
| C. | 点燃乙烯出现黑烟 | |
| D. | 甲烷与氯气的混合气体,光照一段时间后褪色 |