题目内容
10.火法炼铜的原理为Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2,下列说法中正确的是( )| A. | Cu2S只作还原剂 | |
| B. | 该反应是氧化还原反应 | |
| C. | S元素被还原 | |
| D. | 当1 mol O2参加反应时,共转移4 mol e- |
分析 A.还原剂是元素化合价升高的物质;氧化剂是元素化合价降低的物质;
B.还原剂放出氧化反应,氧化剂发生还原反应;
C.化合价升高的元素被氧化;
D.依据化学方程式结合电子守恒分析计算.
解答 解:A.Cu2S 在反应中,铜元素化合价从+1价变化降低为0价,硫元素化合价从-2价升高到+4价;所以Cu2S 在反应中做氧化剂和还原剂,故A错误;
B.该反应中存在元素化合价的变化,属于氧化还原反应,故B正确;
C.Cu2S 在反应中硫元素化合价从-2价升高到+4价,化合价升高做还原剂被氧化发生氧化反应,故C错误;
D.依据反应Cu2S+O2═2Cu+SO2;当1mol O2参加反应时,失电子的是硫元素,得到电子的是铜元素和氧元素,分析计算共转移了6mol电子,故D错误;
故选B.
点评 本题考查了氧化还原反应的概念分析判断,电子转移的计算应用,关键是判断反应前后元素化合价变化,题目难度不大.

练习册系列答案
相关题目
11.下列关于实验操作的叙述正确的是( )
| A. | 石蕊试纸和pH试纸使用前都必须用蒸馏水润湿 | |
| B. | 向沸水中滴加饱和氯化铁溶液并不断搅拌,制取氢氧化铁胶体 | |
| C. | 中和滴定实验时,滴定前仰视刻度,滴定后俯视,则对测得浓度无影响 | |
| D. | 滴定管盛装滴定液前需先用蒸馏水洗净,再用滴定液润洗 |
12.醋酸是一种常见的弱酸,为了证明醋酸是弱电解质,某同学开展了题为“醋酸是弱电解质的实验探究”的探究活动.该同学设计了如下方案,其中错误的是( )
| A. | 先配制一定量的0.10 mol/L CH3COOH溶液,然后测溶液的pH,若pH大于1,则可证明醋酸为弱电解质 | |
| B. | 取等体积、等pH的CH3COOH溶液和盐酸分别与足量锌反应,若测得反应过程中醋酸产生H2较慢且最终产生H2较多,则醋酸为弱酸 | |
| C. | 先配制一定量0.01 mol/L的CH3COOH和0.10 mol/L的CH3COOH,分别用pH计测它们的pH,若两者的pH相差小于1个单位,则可证明醋酸是弱电解质 | |
| D. | 配制一定量的CH3COONa溶液,测其pH,若常温下pH大于7,则可证明醋酸是弱电解质 |
9.下列实验操作正确的是( )
| A. | 蒸馏过程中发现未加沸石,应立即补加沸石 | |
| B. | 分液过程中先将下次液体分出,稍等片刻后再分出上层液体 | |
| C. | 海水提溴即用有机溶剂中海水中萃取溴 | |
| D. | 除去NaCl少量KNO3,可先配成饱和溶液,然后蒸发结晶、趁热过滤 |
5.下列元素中,电负性最大的是( )
| A. | Na | B. | F | C. | O | D. | Cs |
15.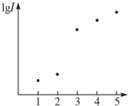 电离能是指从气态原子在基态时失去电子成为阳离子所吸收的能量,如图表示元素X的前五级电离能的对数值,试推测X可能是哪些元素( )
电离能是指从气态原子在基态时失去电子成为阳离子所吸收的能量,如图表示元素X的前五级电离能的对数值,试推测X可能是哪些元素( )
 电离能是指从气态原子在基态时失去电子成为阳离子所吸收的能量,如图表示元素X的前五级电离能的对数值,试推测X可能是哪些元素( )
电离能是指从气态原子在基态时失去电子成为阳离子所吸收的能量,如图表示元素X的前五级电离能的对数值,试推测X可能是哪些元素( )| A. | 第ⅠA族 | B. | 第ⅡA族 | C. | 第ⅢA族 | D. | 第ⅣA族 |
2.下列关于金属元素性质的叙述正确的是( )
| A. | 金属元素的原子只有还原性,离子只有氧化性 | |
| B. | 金属元素在化合物中一定县正化合价 | |
| C. | 金属元素在不同化合物中化合价一定不同 | |
| D. | 金属元素的单质在常温下都是固体 |
19.下列是四种烃的碳骨架,以下关于四种烃的说法不正确的是( )


| A. | a能使高锰酸钾酸性溶液褪色 | B. | b的分子式为C5H12 | ||
| C. | b和c互为同系物 | D. | d为平面形分子,属于烷烃 |
20.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合:c(Na+)=c(Cl-)>cCH3COO-)>c(OH-) | |
| B. | 0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合:3(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] | |
| D. | 0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) |