题目内容
12.醋酸是一种常见的弱酸,为了证明醋酸是弱电解质,某同学开展了题为“醋酸是弱电解质的实验探究”的探究活动.该同学设计了如下方案,其中错误的是( )| A. | 先配制一定量的0.10 mol/L CH3COOH溶液,然后测溶液的pH,若pH大于1,则可证明醋酸为弱电解质 | |
| B. | 取等体积、等pH的CH3COOH溶液和盐酸分别与足量锌反应,若测得反应过程中醋酸产生H2较慢且最终产生H2较多,则醋酸为弱酸 | |
| C. | 先配制一定量0.01 mol/L的CH3COOH和0.10 mol/L的CH3COOH,分别用pH计测它们的pH,若两者的pH相差小于1个单位,则可证明醋酸是弱电解质 | |
| D. | 配制一定量的CH3COONa溶液,测其pH,若常温下pH大于7,则可证明醋酸是弱电解质 |
分析 A.强弱电解质的根本区别是电离程度,部分电离的电解质是弱电解质,完全电离的电解质是强电解质;
B.化学反应速率与离子浓度成正比,pH相同的不同一元酸,弱电解质在反应过程中继续电离导致反应过程中离子浓度大于强电解质;
C.弱电解质溶液在稀释过程中继续电离;
D.强酸强碱盐溶液呈中性,强碱弱酸盐水溶液呈碱性.
解答 解:A.配制一定量的0.10 mol/L CH3COOH溶液,然后测溶液的pH,若pH大于1,醋酸溶液中氢离子浓度小于醋酸浓度,说明醋酸部分电离,则可证明醋酸为弱电解质,故A不选;
B.化学反应速率与离子浓度成正比,pH相同的不同一元酸,弱电解质在反应过程中继续电离导致反应过程中离子浓度大于强电解质,所以取等体积、等pH的CH3COOH溶液和盐酸分别与足量锌反应,反应过程中醋酸继续电离,则醋酸产生H2较快,故B选;
C.0.01 mol•L-1和0.10 mol•L-1的CH3COOH溶液,如果醋酸是强酸,溶液的pH分别是2和1,两者的pH相差1个单位,若两者的pH相差小于1个单位,则可证明醋酸是弱电解质,故C不选;
D.强酸强碱盐溶液呈中性,强碱弱酸盐水溶液呈碱性,配制一定量的CH3COONa溶液,测其pH,若常温下pH大于7,则可证明醋酸是弱电解质,说明醋酸钠是强碱弱酸盐,醋酸为弱酸,则醋酸为弱电解质,故D不选;
故选B.
点评 本题考查强弱电解质判断,为高频考点,明确强弱电解质根本区别是解本题关键,注意:化学反应速率与离子浓度成正比、与电荷成正比,知道弱电解质电离特点,易错选项是B.

练习册系列答案
相关题目
2.下列各项中,能得到氢氧化铝的是( )
| A. | 氧化铝加到热水中 | B. | NaAlO2溶液中加入足量盐酸 | ||
| C. | 铝投入氨水中 | D. | NaOH滴入足量AlCl3溶液中 |
20.下列说法正确的是( )
| A. | 金属腐蚀就是金属原子失去电子被还原的过程 | |
| B. | 钢铁吸氧腐蚀时,负极反应式为2H2O+O2+4e-=4OH- | |
| C. | 镀锌铁皮的镀层损坏后,铁更容易被腐蚀 | |
| D. | 开发核能、风能和太阳能等新能源,都可降低碳排放 |
7.下列加点字的含义不是指“元素”的是( )
| A. | 碘 遇淀粉变蓝 | B. | 钠 的焰色反应为黄色 | ||
| C. | 矿泉水中含有钙、镁等矿物质 | D. | 磷的同素异形体有红磷、白磷等 |
17.下列反应中必须加入还原剂才能进行的是( )
| A. | CuO→Cu | B. | Zn→Zn2+ | C. | H2→H2O | D. | CuO→CuCl2 |
4.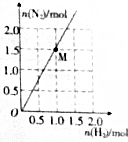 肼是一种优良的贮氢材料,在高温下,N2H4可完全分解为NH3、N2及H2,实验测得分解产物中N2与H2的物质的量的关系如图所示.若该反应中每转移1mol电子吸收30kJ热量,则图中M点时反应吸收的热量为( )
肼是一种优良的贮氢材料,在高温下,N2H4可完全分解为NH3、N2及H2,实验测得分解产物中N2与H2的物质的量的关系如图所示.若该反应中每转移1mol电子吸收30kJ热量,则图中M点时反应吸收的热量为( )
 肼是一种优良的贮氢材料,在高温下,N2H4可完全分解为NH3、N2及H2,实验测得分解产物中N2与H2的物质的量的关系如图所示.若该反应中每转移1mol电子吸收30kJ热量,则图中M点时反应吸收的热量为( )
肼是一种优良的贮氢材料,在高温下,N2H4可完全分解为NH3、N2及H2,实验测得分解产物中N2与H2的物质的量的关系如图所示.若该反应中每转移1mol电子吸收30kJ热量,则图中M点时反应吸收的热量为( )| A. | 120kJ | B. | 180kJ | C. | 240kJ | D. | 360kJ |
10.火法炼铜的原理为Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2,下列说法中正确的是( )
| A. | Cu2S只作还原剂 | |
| B. | 该反应是氧化还原反应 | |
| C. | S元素被还原 | |
| D. | 当1 mol O2参加反应时,共转移4 mol e- |
11.现有三组混合液:①乙酸乙酯和乙酸钠溶液 ②乙醇和丁醇 ③溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
| A. | 分液 蒸馏 萃取 | B. | 萃取 蒸馏 分液 | ||
| C. | 分液 萃取 蒸馏 | D. | 蒸馏 萃取 分液 |
 .
.