题目内容
下列离子方程式正确的是( )
| A、碳酸氢钠溶液与过量石灰水反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
| B、向溴化亚铁溶液中通入过量氯气:Fe2++2Br-+2Cl2=Fe3++Br2+4Cl- |
| C、1 mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积互相均匀混合:2AlO2-+5H+=Al(OH)3↓+Al3++H2O |
| D、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 |
考点:离子方程式的书写
专题:离子反应专题
分析:A、将少的碳酸氢钠当成1mol,电离1mol的碳酸氢根离子需要 1mol的氢氧根离子,生成1 mol 的碳酸根离子,继续跟1mol的钙离子反应;
B、电子得失不守恒;
C、如果两者等体积都为2L,则 NaAlO2 为2mol,HCl为5mol,如果 2mol的NaAlO2完全转化氢氧化铝需盐酸2mol,2mol的NaAlO2完全转化氯化铝需盐酸8mol,2mol<5mol<8mol,故产物中既有氢氧化铝也有氯化铝;
D、HI是一元强酸,电离产生的氢离子和碘离子,其中氢离子和硝酸铁电离出的硝酸根离子构成强氧化性的体系,又因为还原性的强酸过量,所以两种氧化剂都完全反应.
B、电子得失不守恒;
C、如果两者等体积都为2L,则 NaAlO2 为2mol,HCl为5mol,如果 2mol的NaAlO2完全转化氢氧化铝需盐酸2mol,2mol的NaAlO2完全转化氯化铝需盐酸8mol,2mol<5mol<8mol,故产物中既有氢氧化铝也有氯化铝;
D、HI是一元强酸,电离产生的氢离子和碘离子,其中氢离子和硝酸铁电离出的硝酸根离子构成强氧化性的体系,又因为还原性的强酸过量,所以两种氧化剂都完全反应.
解答:
解:A、将少的碳酸氢钠当成1mol,然后用少定多,正确的离子方程式为HCO3-+Ca2++OH-=CaCO3↓+H2O,故A正确;
B、电子得失不守恒,正确的离子方程式为2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,故B错误;
C、如果两者等体积都为2L,则 NaAlO2 为2mol,HCl为5mol,如果 2mol的NaAlO2完全转化氢氧化铝需盐酸2mol,2mol的NaAlO2完全转化氯化铝需盐酸8mol,2mol<5mol<8mol,故产物中既有氢氧化铝又有氯化铝,离子方程式为2AlO2-+5H+=Al(OH)3↓+Al3++H2O,故C正确;
D、HI是一元强酸,电离产生的氢离子和碘离子,其中氢离子和硝酸铁电离出的硝酸根离子构成强氧化性的体系,又因为还原性的强酸过量,所以两种氧化剂都完全反应,正确的离子方程式为Fe3++3NO3-+12H++10I-=Fe2++5I2+3NO↑+6H2O,故D错误;
故选AC.
B、电子得失不守恒,正确的离子方程式为2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,故B错误;
C、如果两者等体积都为2L,则 NaAlO2 为2mol,HCl为5mol,如果 2mol的NaAlO2完全转化氢氧化铝需盐酸2mol,2mol的NaAlO2完全转化氯化铝需盐酸8mol,2mol<5mol<8mol,故产物中既有氢氧化铝又有氯化铝,离子方程式为2AlO2-+5H+=Al(OH)3↓+Al3++H2O,故C正确;
D、HI是一元强酸,电离产生的氢离子和碘离子,其中氢离子和硝酸铁电离出的硝酸根离子构成强氧化性的体系,又因为还原性的强酸过量,所以两种氧化剂都完全反应,正确的离子方程式为Fe3++3NO3-+12H++10I-=Fe2++5I2+3NO↑+6H2O,故D错误;
故选AC.
点评:本题考查离子方程式的书写,题目难度较大,注意从化学式、离子符号、电子得失、物料守恒,过量的离子反应以及是否符合反应实际的角度分析.

练习册系列答案
相关题目
将如图所示实验装置的K闭合,下列判断错误的是( )
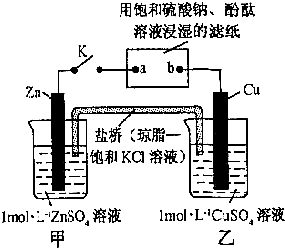

| A、Cu电极上发生还原反应 |
| B、电子沿Zn→a→b→Cu路径流动 |
| C、片刻后盐桥中Cl-向左移动 |
| D、片刻后可观察到滤纸a点变红色 |
下列指定溶液中的离子一定能大量共存的是( )
| A、在足量硝酸中,〔Cu(NH3)4〕2+、Cl-、Na+、Br- | ||
| B、能使碘化钾淀粉试纸变蓝的溶液中,K+、Fe2+、SO42-、Cl- | ||
C、常温下,c(H+)=
| ||
| D、c(OH-)/c(H+)=1×10-12的溶液,NH4+、Mg2+、Cl-、Na+ |
“复盐”是指由多种简单阳离子和一种酸根离子组成的盐,如KAl(SO4)2;而由一种金属离子与多种酸根离子构成的盐则称为“混盐”,如氯化硝酸钙[Ca(NO3)Cl].下列化合物属于混盐的是( )
| A、CaOCl2 |
| B、(NH4)2Fe(SO4)2 |
| C、BiONO3 |
| D、K3[Fe(CN)6] |
乙醇可通过淀粉等生物质原料发酵制得,属于可再生资源,通过乙醇制取氢气具有良好的应用前景.已知通过乙醇制取氢气有如下两条路线:a.水蒸气催化重整:CH3CH2OH(g)+H2O(g)→4H2(g)+2CO(g)△H=+255.58kJ?mol-1b.部分催化氧化:CH3CH2OH(g)+
O2(g)→3H2(g)+2CO(g)△H=+13.76kJ?mol-1
则下列说法错误的是( )
| 1 |
| 2 |
则下列说法错误的是( )
| A、从原料消耗的角度来看,a路线制氢更有价值 |
| B、从能量消耗的角度来看,b路线制氢更加有利 |
| C、a路线制氢由于要消耗很多能量,所以在实际生产中意义不大 |
| D、降低温度,可提高b路线中乙醇的转化率 |
取3.5g某二价金属的单质投入50g溶质质量分数为18.25%的稀盐酸中,反应结束后,金属仍有剩余;若取2.5g该金属投入相同质量、相同质量分数的稀盐酸中,等反应结束后,加入该金属还可以反应.该金属的相对原子质量为( )
| A、24 | B、40 | C、56 | D、65 |
化学反应2NaHCO3
Na2CO3+CO2↑+H2O属于( )
| ||
| A、化合反应 | B、分解反应 |
| C、置换反应 | D、复分解反应 |
 硫的氧化物、氮的氧化物和一氧化碳是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.
硫的氧化物、氮的氧化物和一氧化碳是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.