题目内容
17.下列说法正确的是( )| A. | 乙醇制乙醛、乙酸制乙酸乙酯均为取代反应 | |
| B. | 乙烯制聚乙烯、苯制硝基苯均发生加聚反应 | |
| C. | 蛋白质盐析、糖类水解均为化学变化 | |
| D. | 石油分馏、煤干馏均可得到烃 |
分析 A.乙醇中-OH转化为-CHO,生成乙醛;
B.苯中H被硝基取代;
C.盐析降低溶解度,为物理变化;
D.石油分馏产品中含汽油、煤油,均为烃类物质;煤干馏发生化学变化生成苯等有机物.
解答 解:A.乙醇中-OH转化为-CHO,生成乙醛,为氧化反应,而乙酸制乙酸乙酯为取代反应,故A错误;
B.苯中H被硝基取代,为取代反应,而乙烯制聚乙烯为加聚反应,故B错误;
C.盐析降低溶解度,为物理变化,而糖类水解生成单糖为化学变化,故C错误;
D.石油分馏产品中含汽油、煤油,均为烃类物质;煤干馏发生化学变化生成苯等有机物,石油分馏、煤干馏均可得到烃,故D正确;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的组成、结构与性质、有机反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
7.已知反应:①101kPa时,2C(s)+O2(g)═2CO(g)△H1=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H2=-57.3kJ/mol.
下列结论正确的是( )
②稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H2=-57.3kJ/mol.
下列结论正确的是( )
| A. | 碳的燃烧热用△H3表示,则△H3<△H1 | |
| B. | 碳的燃烧热用△H3表示,则△H3>△H1 | |
| C. | 浓硫酸与稀NaOH溶液反应的中和热值为57.3kJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1mol水,放出的热量57.3KJ |
8.氨基酸在溶液中按两种方式电离以下判断正确的是( )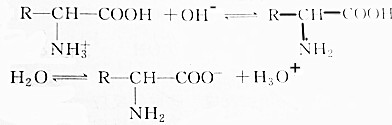
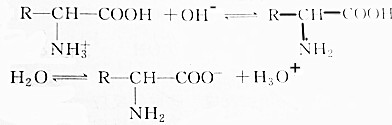
| A. | 增大溶液的pH,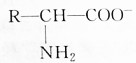 浓度减小 浓度减小 | |
| B. | 降低溶液的pH,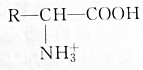 浓度减小 浓度减小 | |
| C. | 如溶液的pH适当,两种氨基酸离子的浓度可能相同 | |
| D. | pH改变,对电离方式无影响 |
5.将NO2、O2、NH3的混合气体26.88L通过H2SO4后,溶液质量增加45.75g,气体体积缩小为2.24L,将带火星的木条插入剩余气体中,木条不复燃.则原混合气体的平均相对分子质量为(气体体积均在标准状况下测定)( )
| A. | 40.625 | B. | 42.15 | C. | 38.225 | D. | 42.625 |
5.用中和滴定法测定烧碱的纯度(烧碱中的杂质不和酸反应),请根据实验回答:
(1)将称量好的4.3g烧碱样品配制成250mL待测液,配制过程使用的主要仪器除250mL容量瓶、量筒、烧杯、胶头滴管外,还有一种必须使用的仪器是玻璃棒.
(2)用碱式滴定管量取10.00mL待测液于锥形瓶中,滴入几滴酚酞.
(3)用0.20mol•L-1的标准盐酸滴定待测液,判断滴定终点的现象是:当滴入最后一滴盐酸,溶液由红色变为无色,且半分钟内不褪色.
(4)如果实验操作正确,从滴定开始到结束,溶液中的离子浓度关系可以出现的是BC(填答案字母序号)
A.c(Na+)>c(Cl-1)>c(H+)>c(OH-)
B.c(Na+)>c(OH-)>c(Cl-1)>c(H+)
C.c(Na+)+c(H+)=c(OH-)+c(Cl-1)
D.c(Na+)+c(H+)>c(OH-)+c(Cl-1)
(5)根据下列数据计算,c(NaOH)=0.40mol/L,烧碱的纯度为93.0%(保留整数)
(6)经过分析发现,本次实验的测定结果比烧碱的实际纯度偏高,造成误差的可能原因是BCD(填答案字母序号)
A.滴定前平视,滴定后俯视
B.未用标准液润洗滴定管
C.用待测液润洗锥形瓶
D.不小心将标准液滴在锥形瓶外面
E.滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁.
(1)将称量好的4.3g烧碱样品配制成250mL待测液,配制过程使用的主要仪器除250mL容量瓶、量筒、烧杯、胶头滴管外,还有一种必须使用的仪器是玻璃棒.
(2)用碱式滴定管量取10.00mL待测液于锥形瓶中,滴入几滴酚酞.
(3)用0.20mol•L-1的标准盐酸滴定待测液,判断滴定终点的现象是:当滴入最后一滴盐酸,溶液由红色变为无色,且半分钟内不褪色.
(4)如果实验操作正确,从滴定开始到结束,溶液中的离子浓度关系可以出现的是BC(填答案字母序号)
A.c(Na+)>c(Cl-1)>c(H+)>c(OH-)
B.c(Na+)>c(OH-)>c(Cl-1)>c(H+)
C.c(Na+)+c(H+)=c(OH-)+c(Cl-1)
D.c(Na+)+c(H+)>c(OH-)+c(Cl-1)
(5)根据下列数据计算,c(NaOH)=0.40mol/L,烧碱的纯度为93.0%(保留整数)
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
A.滴定前平视,滴定后俯视
B.未用标准液润洗滴定管
C.用待测液润洗锥形瓶
D.不小心将标准液滴在锥形瓶外面
E.滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁.
12.下列叙述错误的是( )
| A. | 把aL0.1mol/L的CH3COOH溶液与bL0.1mol/L的KOH溶液混合,所得溶液中一定存在:c(K+)+c(H+)═c(CH3COO-)+c(OH-) | |
| B. | 把0.1mol/L的NaHCO3溶液与0.3mol/L的Ba(OH)2溶液等体积混合,所得溶液中一定存在:c(OH-)>c(Ba+)>c(Na+)>c(H+) | |
| C. | 向1mol/L的CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高 | |
| D. | 常温下,在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度相同. |
10.关于原电池和电解池的叙述正确的是( )
| A. | 原电池中失去电子的电极为阳极 | |
| B. | 原电池的两极一定是由活动性不同的两种金属组成 | |
| C. | 电解时电解池的阳极一定是阴离子放电 | |
| D. | 原电池的负极、电解池的阳极都发生氧化反应 |
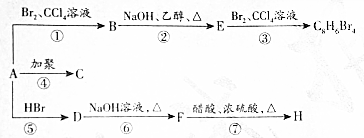
 ,D
,D ,E
,E .
. +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +NaBr(取代反应).
+NaBr(取代反应). ABCDE五种溶液分别是NaOH溶液、氨水、醋酸、盐酸、NH4HSO4溶液的一种.常温下进行下列实验:
ABCDE五种溶液分别是NaOH溶液、氨水、醋酸、盐酸、NH4HSO4溶液的一种.常温下进行下列实验: