题目内容
12.某均匀混合的白色粉末可能含有下列7种常见物质中的某4种:NaCl、BaCl2、Mg(NO3)2、K2CO3、CuSO4、NaHCO3、X,混合物中各成分的物质的量相等,且所含阴、阳离子数目之比为3:2,某同学做了以下实验,部分现象没有描述.根据所提供的实验现象,下列对该白色粉末的判断正确的是( )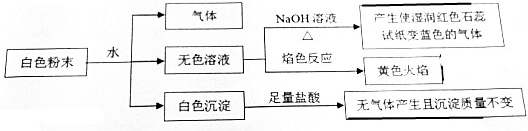
| A. | 一定含有BaCl2、Mg(NO3)2、NaHCO3、X,且X是NH4HSO4 | |
| B. | 一定不含K2CO3、CuSO4,X是NH4Al(SO4)2 | |
| C. | 一定含有BaCl2、NaHCO3、X且X是NH4AlO2,另一种为NaCl和Mg(NO3)2中的任一种 | |
| D. | 一定含有NaCl、BaCl2、NaHCO3和X,当X不能确定是什么物质 |
分析 均匀混合的白色粉末一定不含CuSO4,粉末加水会产生气体,可以确定X中能电离出氢离子,产生白色的沉淀,说明该沉淀不溶于强酸中,所以沉淀是含钡离子的硫酸钡沉淀,所以X中含有硫酸根离子,一定含有碳酸氢钠,加水产生气体是二氧化碳,加水后的无色溶液加入氢氧化钠加热能产生氨气,所以无色溶液中含有铵根离子,溶液颜色反应是黄色,所以其中一定含有钠离子,据此回答判断得到答案.
解答 解:均匀混合的白色粉末一定不含CuSO4,粉末加水会产生气体,可以确定X中能电离出氢离子,产生白色的沉淀,说明该沉淀不溶于强酸中,所以沉淀是含钡离子的硫酸钡沉淀,一定含有BaCl2,一定不含K2CO3,所以X中含有硫酸根离子,一定含有碳酸氢钠,加水产生气体是二氧化碳,加水后的无色溶液加入氢氧化钠加热能产生氨气,所以无色溶液中含有铵根离子,溶液颜色反应是黄色,所以其中一定含有钠离子,混合物中各成分的物质的量相等,且所含阴、阳离子数目之比为3:2,一定含有硝酸镁,综上得到:粉末中一定含有BaCl2、Mg(NO3)2、NaHCO3、X,且X是NH4HSO4,一定不含K2CO3、CuSO4,故选A.
点评 题主要考查的是无机物的推断,熟练掌握各种物质的性质以及它们之间的反应是解决本题的关键.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
17.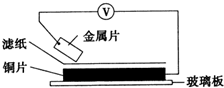 将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下:
将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下:
已知构成两电极的金属,其金属活泼性相差越大,电压表的读数越大.请依据记录数据判断,下列有关说法正确的是( )
 将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下:
将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下:| 金属 | 电子流动方向 | 电压/V |
| 甲 | 甲→Cu | +0.78 |
| 乙 | Cu→乙 | -0.15 |
| 丙 | 丙→Cu | +1.35 |
| 丁 | 丁→Cu | +0.30 |
| A. | 在四种金属中丙的还原性最强 | |
| B. | 金属乙能从硫酸铜溶液中置换出铜 | |
| C. | 甲、丁若形成原电池时,甲为正极 | |
| D. | 甲、乙形成合金时,将该合金露置在空气中,乙先被腐蚀 |
7.下列实验操作不会引起误差的是( )
| A. | 酸碱中和滴定时,用待测液润洗锥形瓶 | |
| B. | 酸碱中和滴定时,用冲洗干净的滴定管盛装标准溶液 | |
| C. | 用NaOH标准溶液测定未知浓度的盐酸溶液时,锥形瓶使用前中含有少量水 | |
| D. | 用标准盐酸测定未知浓度NaOH溶液,结束实验时,酸式滴定管尖嘴部分有气泡,开始实验时无气泡 |
17.下列离子方程式或说法正确的是( )
| A. | 向Fe(NO3)2和KI混合溶液中加入少量稀盐酸:6I-+8H++2NO3-=3I2+4H2O+2NO↑ | |
| B. | 非金属元素形成的化合物一定是共价化合物 | |
| C. | SO2通入Ca(ClO)2溶液中:SO2+Ca(ClO)2+H2O=CaSO3↓+2HClO | |
| D. | 只含有共价键的物质一定是共价化合物 |
1.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,错误的是( )
| A. | 钢铁腐蚀时可能发生的正极反应 2H2O+O2+4e-═4OH- | |
| B. | 表示H2燃烧热的热化学方程式 2H2(g)+O2 (g)═2H2O(g);△H=-483.6kJ/mol | |
| C. | 纯碱水解的离子方程式 CO32-+H2O?HCO3-+OH- | |
| D. | Ca(HCO3)2溶液中加入过量澄清石灰水 Ca2++HCO3-+OH-═CaCO3↓+H2O |
2.下列说法符合化学事实的是( )
| A. | 大分子化合物油脂在人体内水解为氨基酸和甘油等小分子才能被吸收 | |
| B. | 包装食品里常有硅胶、石灰、还原铁粉三类小包,其作用相同 | |
| C. | Na2SiO3水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料 | |
| D. | 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 |
 水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题: