题目内容
下列各表述与示意图一致的是( )
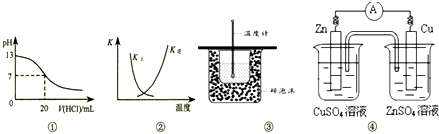

| A、图①表示25℃时,用0.1 mol?L-1盐酸滴定20 mL 0.1 mol?L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
| B、图②中曲线表示反应2SO2(g)+O2(g)?2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 |
| C、图③装置用于测定中和热 |
| D、图④装置可以构成锌、铜、硫酸铜溶液原电池 |
考点:原电池和电解池的工作原理,化学平衡的影响因素,中和滴定
专题:图示题
分析:A、当溶液pH=7时,氢氧化钠就与氯化氢恰好反应,滴定曲线应该有一个滴定突变;
B、该反应为放热反应,温度升高,平衡向着逆向移动,K(逆)增大、K(正)减小;
C、缺少环形玻璃搅拌器;
D、Zn应放在硫酸锌溶液中,铜放入硫酸铜溶液中.
B、该反应为放热反应,温度升高,平衡向着逆向移动,K(逆)增大、K(正)减小;
C、缺少环形玻璃搅拌器;
D、Zn应放在硫酸锌溶液中,铜放入硫酸铜溶液中.
解答:
解:A、用盐酸滴定氢氧化钠溶液,当恰好中和时溶液的pH=7,酸碱中和在接近终点时,pH会发生突变,曲线的斜率会很大,题中图象变化与实际不相符,故A错误;
B、因反应为放热反应,则升高温度,平衡逆向移动,平衡后升温K(逆)会增大,而K(正)会减小,图象中变化与实际上的变化相符,故B正确;
C、缺少环形玻璃搅拌器,故C错误;
D、Zn应放在硫酸锌溶液中,铜放入硫酸铜溶液中,故D错误;
故选B.
B、因反应为放热反应,则升高温度,平衡逆向移动,平衡后升温K(逆)会增大,而K(正)会减小,图象中变化与实际上的变化相符,故B正确;
C、缺少环形玻璃搅拌器,故C错误;
D、Zn应放在硫酸锌溶液中,铜放入硫酸铜溶液中,故D错误;
故选B.
点评:本题以图象与中和滴定、化学平衡、中和热的测定、原电池等知识,题目难度中等,注意抓住图象的“形变神不变”对图象进行分析,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
工业上由二氧化锰制备高锰酸钾可分二步进行,第一步:二氧化锰与氢氧化钾共熔并通入氧气2MnO2+4KOH+O2
2K2MnO4+2H2O;第二步:电解锰酸钾溶液:2K2MnO4+2H2O
2KMnO4+H2↑+2KOH则下列说法正确的是( )
| ||
| ||
| A、根据上述过程,每生成1molKMnO4,共转移6mol电子 | ||||
B、第二步电解时,阳极电极反应式为2MnO
| ||||
C、第二步电解的离子方程式为:2H2O
| ||||
| D、第二步电解时阴极周围pH减小 |
下列有关平衡常数的说法中,正确的是( )
| A、改变条件,反应物的转化率增大,平衡常数也一定增大 | ||||||
| B、反应2NO2(g)═N2O4(g)△H<0,升高温度该反应平衡常数增大 | ||||||
| C、对于给定可逆反应,温度一定时,其正、逆反应的平衡常数相等 | ||||||
D、CO2+H2
|
下列关于催化剂的说法,正确的是( )
| A、催化剂能使不起反应的物质发生反应 |
| B、在化学反应前后催化剂性质和质量都发生改变 |
| C、催化剂能改变化学反应速率 |
| D、在化学反应过程中,一定不参与化学反应 |
下列反应属于吸热反应的是( )
| A、镁条与盐酸反应 |
| B、甲烷燃烧 |
| C、生石灰与水反应 |
| D、高温锻烧石灰石 |
下列反应中,属于吸热反应的是( )
| A、乙醇燃烧 |
| B、Ba(OH)2?8H2O和NH4Cl固体反应 |
| C、铝与盐酸反应 |
| D、盐酸和氢氧化钠反应 |
取100mL0.3mol/L的H2SO4溶液和300mL 0.25mol/L的H2SO4溶液注入500mL容量瓶中,再加水至刻度线,所得溶液中C(H2SO4)为.( )
| A、0.265mol/L |
| B、0.525mol/L |
| C、0.21mol/L |
| D、0.42mol/L |