题目内容
18.下表是周期表中的一部分,根据①-⑩在周期表中的位置,用元素符号或化学式回答下列问题:| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ④ | ⑦ | ⑧ | ⑩ | ||||
| 3 | ② | ③ | ⑤ | ⑥ | ⑨ |
(2)最高价氧化物的水化物酸性最强的是HClO4,呈两性的是Al(OH)3,最高价氧化物的水化物碱性最强的是NaOH,电子式为
 ;
;(3)在②、③、④、⑤、⑥、⑦、⑧、⑨中,原子半径最大的是Na;
(4)比较⑥⑦⑨氢化物的稳定性最弱的是PH3;
(5)③元素单质和②元素最高价氧化物对应的水化物相互反应的离子方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑;
(6)铍(Be)位于元素周期表中第二周期第ⅡA族.相同条件下,单质铍与酸反应比单质锂与酸反应更加缓慢(填“剧烈”或“缓慢”),写出铍与盐酸反应的化学方程式Be+2HCl═BeCl2+H2↑.
分析 由元素在周期表中的位置可知,①为H,②为Na,③为Al,④为C,⑤为Si,⑥为P,⑦为O,⑧为F,⑨为Cl,⑩为Ne.
(1)稀有气体化学性质最不活泼;氧元素、氟元素没有正化合价;同周期自左而右金属性减弱,同主族自上而下金属性增强,金属性越强,单质的还原性越强;可用于制半导体材料的元素是硅;
(2)F元素没有最高价含氧酸,最高价氧化物的水化物酸性最强的是高氯酸,氢氧化铝是两性氢氧化物,上述元素中Na的金属性最强,故最高价氧化物的水化物碱性最强的是NaOH;
(3)同周期自左而右原子半径减小,一般电子层越多原子半径越大;
(4)非金属性越强,对应氢化物越稳定;
(5)②元素最高价氧化物对应的水化物为NaOH,Al与氢氧化钠溶液反应生成偏铝酸钠与氢气;
(6)Be的金属性比Li的弱,Be与盐酸发生置换反应生成BeCl2与H2.
解答 解:由元素在周期表中的位置可知,①为H,②为Na,③为Al,④为C,⑤为Si,⑥为P,⑦为O,⑧为F,⑨为Cl,⑩为Ne.
(1)稀有气体Ne化学性质最不活泼;氧元素、氟元素没有正化合价;同周期自左而右金属性减弱,同主族自上而下金属性增强,Na的金属性最强,单质的还原性最强;可用于制半导体材料的元素是硅,
故答案为:Ne;F、O;Na;Si;
(2)F元素没有最高价含氧酸,最高价氧化物的水化物酸性最强的是HClO4,Al(OH)3是两性氢氧化物,上述元素中Na的金属性最强,故最高价氧化物的水化物碱性最强的是NaOH,电子式为
故答案为:HClO4;Al(OH)3;NaOH; ;
;
(3)同周期自左而右原子半径减小,一般电子层越多原子半径越大,原子半径最大的是Na,
故答案为:Na;
(4)O、Cl、P中P的非金属性最弱,非金属性越强,对应氢化物越稳定,故PH3 稳定性最弱,
故答案为:PH3;
(5)②元素最高价氧化物对应的水化物为NaOH,Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
(6)Be的金属性比Li的弱,单质铍与酸反应比单质锂与酸反应更加缓慢,Be与盐酸发生置换反应生成BeCl2与H2,反应方程式为:Be+2HCl═BeCl2+H2↑,
故答案为:缓慢;Be+2HCl═BeCl2+H2↑.
点评 本题考查元素周期表与元素周期律综合应用,侧重对元素周期律与化学用语的考查,注意掌握金属性、非金属强弱比较实验事实.

| A. |  测量钠与乙醇反应生成H2的体积 | B. |  制取乙烯 | ||
| C. |  蒸馏石油 | D. |  制取乙酸乙酯 |
| A. | Na放入水中,产生气体:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | FeCl3溶液刻蚀印刷线路板:2Fe3++Cu═2Fe2++Cu2+ | |
| C. | 铜溶于稀HNO3溶液:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O |
| A. | 晶胞是晶体的最小的结构重复单元 | |
| B. | 不同的晶体中晶胞的大小和形状都相同 | |
| C. | 晶胞中的任何一个粒子都属于该晶胞 | |
| D. | 已知晶胞的组成不能推知晶体的组成 |
①向甲溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成;
②丙将溶液分别与其它三种物质的溶液混合,均有白色沉淀生成;
③1mol/L丁溶液中c(H+)=2mol/L.
下列结论不正确的是( )
| A. | 甲溶液含有Cl- | B. | 乙溶液含有Mg2+ | C. | 丙溶液含有Ba2+ | D. | 丁溶液含有SO42- |
| A. | CCl4、SiCl4、SiH4 | B. | H2S、NCl3、CH4 | ||
| C. | BCl3、CH2═CH2、环己烷 | D. | SO3、C6H6(苯)、CH3C≡CH |
| A. | 甲苯和液溴光照取代产物为 | |
| B. | 乙苯和氯气光照生成产物有11种 | |
| C. | 邻二甲苯和液溴在光照下取代产物可能为 | |
| D. | 甲苯和氯气在光照条件下生成一氯代物有4种 |
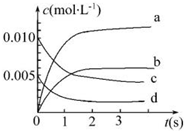 在2L密闭容器内,800℃时反应2NO(g)+O2(g)=2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)=2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图中表示NO2变化曲线的是b.用O2表示0~2s内该反应的平均速率v=0.0015mol•L-1•S-1.
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v (O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变.
| A. | CuSO4溶液中:Na+、NH4+、K+、NO3-、Mg2+ | |
| B. | 使酚酞变红色的溶液中:NH4+、Zn2+、Cl-、NO3- | |
| C. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、AlO2-、SO32- | |
| D. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- |