题目内容
9.下列解释事实的离子方程式不正确的是( )| A. | Na放入水中,产生气体:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | FeCl3溶液刻蚀印刷线路板:2Fe3++Cu═2Fe2++Cu2+ | |
| C. | 铜溶于稀HNO3溶液:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O |
分析 A.二者反应生成氢氧化钠和氢气;
B.三价铁离子能够氧化铜生成二价铁离子和铜离子;
C.二者反应生成硝酸铜、一氧化氮和水;
D.不符合反应客观事实.
解答 解:A.Na放入水中,产生气体,离子方程式:2Na+2H2O═2Na++2OH-+H2↑,故A正确;
B.FeCl3溶液刻蚀印刷线路板,离子方程式:2Fe3++Cu═2Fe2++Cu2+,故B正确;
C.铜溶于稀HNO3溶液,离子方程式:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故C正确;
D.向AlCl3溶液中加入过量的氨水,离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故D错误;
故选:D.
点评 本题考查离子反应方程式的正误判断,明确发生的化学反应及离子反应的书写方法即可解答,注意离子反应遵循客观事实,遵循原子个数、电荷受恒规律,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.下列原子或离子的电子排布的表示方法中,违反洪特规则的是( )
①Ca2+:1s22s22p63s23p6
②F-:1s22s23p6
③P: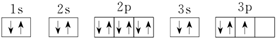
④Cr:1s22s22p63s23p63d44s2
⑤Fe:1s22s22p63s23p63d64s2
⑥Mg2+:1s22s22p6
⑦C: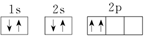
①Ca2+:1s22s22p63s23p6
②F-:1s22s23p6
③P:

④Cr:1s22s22p63s23p63d44s2
⑤Fe:1s22s22p63s23p63d64s2
⑥Mg2+:1s22s22p6
⑦C:

| A. | ①③⑥ | B. | ②④⑦ | C. | ③④⑥ | D. | ③④⑦ |
17.下列叙述中,错误的是( )
| A. | 石油的催化重整是获得芳香烃的主要途径 | |
| B. | 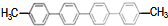 苯环上的一氯代物有4种 苯环上的一氯代物有4种 | |
| C. | 燃烧等质量的甲烷和丙烯,丙烯需要的O2更多 | |
| D. | 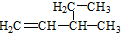 命名为3-甲基-1-戊烯 命名为3-甲基-1-戊烯 |
4.要证明某溶液中不含有Fe3+,而可能含有Fe2+,合理顺序是( )
①加入足量氯水 ②取少量试液 ③加入少量KSCN溶液.
①加入足量氯水 ②取少量试液 ③加入少量KSCN溶液.
| A. | ①③② | B. | ①②③ | C. | ②③① | D. | ②①③ |
14.电动自行车由于灵活、快捷、方便,已成为上班族的主要代步工具,其电源常采用铅蓄电池,反应原理为PbO2+Pb+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O,下列叙述正确的是( )
| A. | 电池放电时,PbO2是电池的正极,被氧化 | |
| B. | 电池放电时,SO42-只在负极发生反应 | |
| C. | 电池放电时,溶液的pH不断减小 | |
| D. | 电池放电时,正极反应式为PbO2+4H++SO42-+2e-═PbSO4+2H2O |
1.下列过程有热量放出的是( )
| A. | 水变成水蒸气 | B. | Ba(OH)2•8H2O晶体与NH4Cl晶体反应 | ||
| C. | 焦炭与二氧化碳气体发生的反应 | D. | Na与H2O反应 |
18.下表是周期表中的一部分,根据①-⑩在周期表中的位置,用元素符号或化学式回答下列问题:
(1)表中元素,化学性质最不活泼的是Ne,只有负价而无正价的是F、O,还原性最强的单质是Na,可用于制半导体材料的元素是Si;
(2)最高价氧化物的水化物酸性最强的是HClO4,呈两性的是Al(OH)3,最高价氧化物的水化物碱性最强的是NaOH,电子式为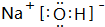 ;
;
(3)在②、③、④、⑤、⑥、⑦、⑧、⑨中,原子半径最大的是Na;
(4)比较⑥⑦⑨氢化物的稳定性最弱的是PH3;
(5)③元素单质和②元素最高价氧化物对应的水化物相互反应的离子方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑;
(6)铍(Be)位于元素周期表中第二周期第ⅡA族.相同条件下,单质铍与酸反应比单质锂与酸反应更加缓慢(填“剧烈”或“缓慢”),写出铍与盐酸反应的化学方程式Be+2HCl═BeCl2+H2↑.
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ④ | ⑦ | ⑧ | ⑩ | ||||
| 3 | ② | ③ | ⑤ | ⑥ | ⑨ |
(2)最高价氧化物的水化物酸性最强的是HClO4,呈两性的是Al(OH)3,最高价氧化物的水化物碱性最强的是NaOH,电子式为
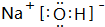 ;
;(3)在②、③、④、⑤、⑥、⑦、⑧、⑨中,原子半径最大的是Na;
(4)比较⑥⑦⑨氢化物的稳定性最弱的是PH3;
(5)③元素单质和②元素最高价氧化物对应的水化物相互反应的离子方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑;
(6)铍(Be)位于元素周期表中第二周期第ⅡA族.相同条件下,单质铍与酸反应比单质锂与酸反应更加缓慢(填“剧烈”或“缓慢”),写出铍与盐酸反应的化学方程式Be+2HCl═BeCl2+H2↑.
19.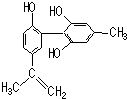 我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
 我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )| A. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| B. | 滴入KMnO4(H+)溶液,观察紫色褪去,说明结构中有一定存在不饱和碳碳双键 | |
| C. | 1 mol该物质分别与浓溴水、H2反应时最多消耗Br2和H2分别为4mol、7 mol | |
| D. | 该分子中的所有原子有可能共平面 |
 短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: