题目内容
7.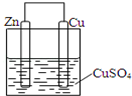 某同学设计的原电池如图所示,回答下列问题:
某同学设计的原电池如图所示,回答下列问题:①写出铜锌原电池工作时电极反应方程式:负极:Zn-2e-=Zn2+;正极:Cu2++2e-=Cu
②若正极质量增重12.8g,则该原电池转移了0.4mol电子.
分析 ①该原电池中负极为较活泼金属锌,发生氧化反应,铜作正极,铜上铜离子得电子;
②根据电极方程式中物质与电子之间的关系计算.
解答 解:①Zn比Cu活泼,应为原电池的负极,发生氧化反应,电极方程式为Zn-2e-=Zn2+,铜作正极,正极上铜离子得电子发生还原反应生成铜单质,Cu2++2e-=Cu,
故答案为:Zn-2e-=Zn2+;Cu2++2e-=Cu;
②正极的电极反应式为Cu2++2e-=Cu,若正极质量增重12.8g,即生成的Cu为0.2mol,则转移的电子为0.4mol,故答案为:0.4.
点评 本题考查原电池的组成和工作原理,涉及到电池的分类、电子的流向、反应的类型判断以及正负极的判断,题目难度不大,建议把相关基础知识掌握好.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
18.①乙酸乙酯 ②淀粉 ③蛋白质 ④油脂,在稀酸存在下分别进行水解,最终生成物只有一种的是( )
| A. | ①和② | B. | 只有② | C. | ②③和④ | D. | 只有④ |
12.下列事实中,不能用化学平衡移动(勒夏特列)原理解释的是( )
| A. | 新制氯水中加CaCO3后,溶液漂白性增强 | |
| B. | 盛有NO2、N2O4混合气体的烧瓶置于冰水中,气体颜色变浅 | |
| C. | 反应:H2(g)+I2(g)?2HI(g) 达平衡后,减小气体体积,气体颜色变深 | |
| D. | 恒温等容时,在SO2,O2和SO3的平衡体系中加入氧气,提高SO2的转化率 |
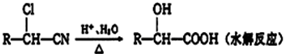
 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$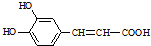 +H2O
+H2O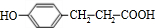 .
. 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.据此回答:
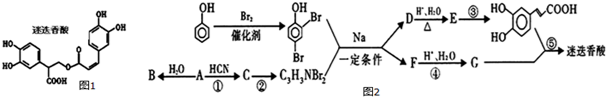
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.据此回答: 的合成路线(部分反应条件略去)如图所示.
的合成路线(部分反应条件略去)如图所示.

 ,D→E的反应类型为取代反应或水解反应.
,D→E的反应类型为取代反应或水解反应. .
.  中最多有10个原子共平面,
中最多有10个原子共平面, 发生缩聚反应生成有机物的结构简式为
发生缩聚反应生成有机物的结构简式为 .
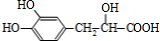
. (写结构简式).
(写结构简式).