题目内容
17.辉铜矿(Cu2S)可发生反应:2Cu2S+2H2SO4+5O2═4CuSO4+2H2O,该反应的还原剂是当1mol O2发生反应时,还原剂所失电子的物质的量为4mol,其中被S元素还原的O2的物质的量为0.8mol.分析 该反应中Cu元素化合价由+1价变为+2价、S元素化合价由-2价变为+6价,O元素化合价由0价变为-2价,所以Cu2S是还原剂,1mol氧气发生化学反应时,有0.4molCu2S参加反应,氧化还原中得失电子数相等,根据Cu2S中元素化合价变化计算失去电子物质的量.
解答 解:该反应中Cu元素化合价由+1价变为+2价、S元素化合价由-2价变为+6价,O元素化合价由0价变为-2价,所以Cu2S是还原剂、O2是氧化剂,1mol氧气发生化学反应时,有0.4molCu2S参加反应,氧化还原反应中转移电子相等,则还原剂失去电子的物质的量=0.4mol×[2×(2-1)+1×(6+2)]=4mol,1mol O2发生反应时参加反的硫的物质的量为0.4mol,根据得失电子守恒,被S元素还原的O2的物质的量为$\frac{0.4×[6-(-2)]}{4}$=0.8mol,
故答案为:Cu2S;4;0.8.
点评 本题考查氧化还原反应,为高频考点,明确发生的反应及反应中元素的化合价变化即可解答,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
5.下列说法不正确的是( )
| A. | 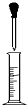 用量筒量取一定量液体时,先从试剂瓶中直接倒入大部分试剂于量筒中,至接近刻度时改用如图所示操作,逐滴加入至刻度 用量筒量取一定量液体时,先从试剂瓶中直接倒入大部分试剂于量筒中,至接近刻度时改用如图所示操作,逐滴加入至刻度 | |
| B. | 金属镁因保存不当造成失火可用细沙盖灭,不能用泡沫灭火器 | |
| C. | 探究温度对化学反应速率影响时,先将硫代硫酸钠与硫酸两种溶液混合后再用水浴加热 | |
| D. | 热化学方程式中,如果没有注明温度和压强,表示反应热是在25℃,101KPa测得的 |
12.下列关于物质物分类的说法正确的组合是( )
①非金属氧化物一定是酸性氧化物
②金属氧化物不一定是碱性氧化物
③碱性氧化物一定是金属氧化物
④Na2O和Na2O2均能与H2O反应生成NaOH,故二者都是碱性氧化物
⑤纯净物是由一种元素组成,而混合物由两种或两种以上元素组成
⑥只由一种元素的阳离子与另一种元素的阴离子组成的物质一定为纯净物.
①非金属氧化物一定是酸性氧化物
②金属氧化物不一定是碱性氧化物
③碱性氧化物一定是金属氧化物
④Na2O和Na2O2均能与H2O反应生成NaOH,故二者都是碱性氧化物
⑤纯净物是由一种元素组成,而混合物由两种或两种以上元素组成
⑥只由一种元素的阳离子与另一种元素的阴离子组成的物质一定为纯净物.
| A. | ①④⑤⑥ | B. | ②③ | C. | ③④⑥ | D. | ②③⑥ |
2.将一小块钠投入下列溶液中,既能产生气体又会出现沉淀的是( )
| A. | 稀H2SO4 | B. | 氢氧化钠溶液 | C. | NH4Cl溶液 | D. | 氯化镁溶液 |
7.某温度下,浓度都是1mol•L-1的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t min后,测得各物质的浓度分别为c(X2)=0.4mol•L-1,c(Y2)=0.6mol•L-1,c(Z)=0.4mol•L-1,则该反应的化学方程式可表示为( )
| A. | 2X2+3Y2?2X2Y3 | B. | 3X2+2Y2?2X3Y2 | C. | X2+2Y2?XY2 | D. | 2X2+Y2?2X2Y |
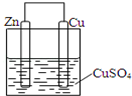 某同学设计的原电池如图所示,回答下列问题:
某同学设计的原电池如图所示,回答下列问题: 病人输液用的葡萄糖注射液是葡萄糖(C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签所提供的信息,回答下列问题:
病人输液用的葡萄糖注射液是葡萄糖(C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签所提供的信息,回答下列问题:
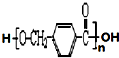
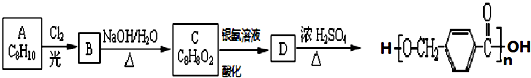
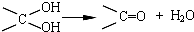
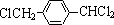 ,其中的官能团名称为氯原子.
,其中的官能团名称为氯原子.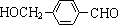 +2Ag(NH3)2OH $\stackrel{△}{→}$
+2Ag(NH3)2OH $\stackrel{△}{→}$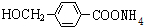 +2Ag↓+3NH3+H2O,由D生成高分子化合物的反应n
+2Ag↓+3NH3+H2O,由D生成高分子化合物的反应n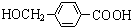 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$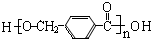 +(n-1)H2O
+(n-1)H2O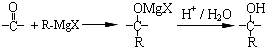
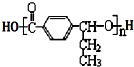 在合成过程中所用的格氏试剂的化学式为CH3CH2MgX(用X表示卤原子),合成过程中涉及到的有机化学反应类型有ACD(填编号)
在合成过程中所用的格氏试剂的化学式为CH3CH2MgX(用X表示卤原子),合成过程中涉及到的有机化学反应类型有ACD(填编号)