题目内容
9.铁的某种氧化物的组成可表示为FemOn,FemOn与足量稀硝酸反应时,参加反应的硝酸中,被还原的硝酸与没有被还原的硝酸物质的量之比为1:18,则m、n的值分别为( )| A. | 4、5 | B. | 5、4 | C. | 3、4 | D. | 5、7 |
分析 根据3FemOn+(12m-2n)HNO3=3mFe(NO3)3+(3m-2n)NO↑+(6m-n)H2O,由方程式被还原的硝酸物质的量(3m-2n)与没有被还原的硝酸物质的量为9m,由(3m-2n):9m=1:18,m、n是正整数,由此分析解答.
解答 解:根据3FemOn+(12m-2n)HNO3=3mFe(NO3)3+(3m-2n)NO↑+(6m-n)H2O,由方程式被还原的硝酸物质的量(3m-2n)与没有被还原的硝酸物质的量为9m,由(3m-2n):9m=1:18,得5m=4n,则m、n的值分别为4、5,故选A.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中电子守恒和原子守恒的应用为解答的关键,侧重分析与计算能力的考查,题目难度中等.

练习册系列答案
相关题目
19.水的摩尔质量是( )
| A. | 18 | B. | 18mol | C. | 18 g | D. | 18g/mol |
20.用NA表示阿伏加德罗常数值.下列叙述正确的是( )
| A. | 64g SO2含有氧原子数为NA | |
| B. | 物质的量浓度为0.5mol/L MgCl2溶液,含有Cl-离子数为NA | |
| C. | 0.5NA个O2的质量为32g | |
| D. | 常温常压下,14g N2含有分子数为0.5NA |
17.下列反应中的氨与反应4NH3+5O2═4NO+6H2O中的氨作用相同的是( )
| A. | 2Na+2NH3═2NaNH2+H2↑ | B. | 2NH3+3CuO═3Cu+N2+3H2O | ||
| C. | NH3+HNO3═NH4NO3 | D. | 3SiH4+4NH3═Si3N4+12H2 |
4.卤族元素随着原子核电荷数的增加,下列叙述不正确的是( )
| A. | 原子半径依次增大 | B. | 单质的熔沸点逐渐升高 | ||
| C. | 卤离子的还原性逐渐减弱 | D. | 氢化物的热稳定性依次减弱 |
14.下列图示与对应叙述相符合的是( )


| A. | 图 I:反应 N2+3H 2?2NH3在恒温情况下,反应速率与压强的关系 | |
| B. | 图Ⅱ:反应 H2+I2?2HI 达平衡后,升高温度时反应速率随时间的变化 | |
| C. | 图 III:反应 CO2(g)+H2(g)?CO(g)+H2O(g)△H>0,水蒸气含量随时间的变化 | |
| D. | 图 IV:反应 2SO2+O2?2SO3 达平衡后,缩小容器体积,各成分物质的量随时间的变化 |

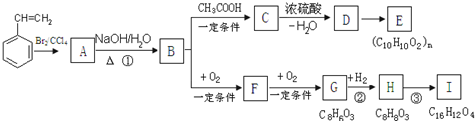
 .
.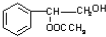 或
或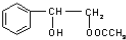 .
.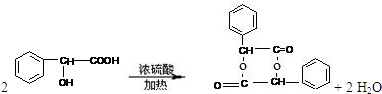 .
.