题目内容
11.红矾钠(重铬酸钠:Na2Cr2O7•2H2O)是重要的基本化工原料,应用十分广泛.工业制备红矾钠的流程如下请回答下列问题:
(1)Cr3+的基态电子排布式为1s22s22p63s23p63d3.
(2)锻烧铬铁矿发生反应:Fe(CrO2)2+Na2CO3+O2$\stackrel{高温}{→}$Fe2O3+Na2CrO4+CO2
配平上述化学反应方程式4Fe(CrO2)2+8Na2CO3+7O2$\frac{\underline{\;高温\;}}{\;}$8Na2CrO4+2Fe2O3+8CO2.
分析 (1)Cr元素是24号元素,Cr原子形成离子先失去高能层中的电子,结合核外电子排布规律书写;
(2)反应只有O元素的化合价降低,由0价降低为-2价,还原剂是FeO•Cr2O3,铁元素和铬元素失电子化合价升高,氧化还原反应中,元素化合价升高值等于元素化合价降低值,根据电子守恒来配平方程式.
解答 解:(1)Cr元素是24号元素,Cr原子的核外电子排布式为1s22s22p63s23p63d54s1,故Cr3+的基态电子排布式为1s22s22p63s23p63d3,
故答案为:1s22s22p63s23p63d3;
(2)该反应中元素的化合价变化如下:O2→O,O元素的化合价由价0→-2价,一个O2得到4个电子;
Fe(CrO2)2→Fe2O3,Fe(CrO2)2→Na2CrO4,Fe元素的化合价由+2价→+3价,失去e-,Cr元素的化合价由+3价→+6价,失去3e-,1molFeO•Cr2O3失去7mol电子,1molO2得到4mol电子,化合价升高数=化合价降低数,所以得失电子的最小公倍数为28,所以方程式为:4Fe(CrO2)2+8Na2CO3+7O2$\frac{\underline{\;高温\;}}{\;}$8Na2CrO4+2Fe2O3+8CO2,
故答案为:4Fe(CrO2)2+8Na2CO3+7O2$\frac{\underline{\;高温\;}}{\;}$8Na2CrO4+2Fe2O3+8CO2.
点评 本题考查了元素化合物以及电子排布式知识,侧重考查氧化还原反应方程式的书写,根据氧化还原反应中得失电子数相等和原子守恒配平,明确元素的化合价是解本题的关键,题目难度中等.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案
相关题目
10.下列反应中,能放出气体,又属于非氧化还原反应的是( )
| A. | 浓盐酸与二氧化锰共热 | B. | 浓硫酸与铜共热 | ||
| C. | 过氧化钠与水反应 | D. | 石灰石与稀盐酸反应 |
11.已知某元素的阳离子R2+的核内中子数为n,质量数为A,则mg它的氧化物中所含电子的物质的量是( )
| A. | $\frac{m}{A+16}$(A-n+8)mol | B. | $\frac{m}{A+16}$(A-n+10)mol | C. | (A-n+2)mol | D. | $\frac{m}{A}$(A-n+6)mol |
16.下列物质互为同系物的是( )
| A. | 乙烯和1,3-丁二烯 | B. | CH3Cl和CH2Cl2 | ||
| C. | 乙烯和聚乙烯 | D. | 苯和二甲苯 |
3.如图所示是气体性质实验的常用装置,下列有关实验现象的说法不正确的是( )
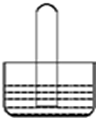

| A. | 若水槽中是水,试管中是NO2,可看到液面上升并且气体颜色逐渐变浅 | |
| B. | 若水槽中是NaOH溶液,试管中是Cl2,可看到液面上升、试管中黄绿色褪去 | |
| C. | 若水槽中是水并滴有几滴紫色石蕊,试管中是SO2,可看到液面上升并变为无色 | |
| D. | 若水槽中是水并滴有几滴酚酞,试管中是NH3,可看到液面上升并呈红色 |
20.某密闭容器中,有下列反应发生:A(g)+3B(g)?2C(g)+D(g).若0-2min时间段内v(A)=1mol/(L•min),则此段时间v(C)为( )
| A. | 0.5 mol/(L•min) | B. | 1 mol/(L•min) | C. | 2 mol/(L•min) | D. | 3 mol/(L•min) |
1.按官能团分类,下列说法正确的是( )
| A. |  属于芳香族化合物 属于芳香族化合物 | B. |  属于羧酸 属于羧酸 | ||
| C. |  属于醛类 属于醛类 | D. |  属于酚类 属于酚类 |
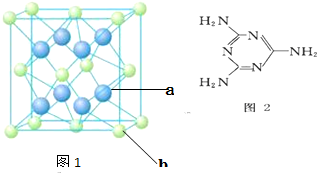 X、Y、Z、M、N、Q P为元素周期表前四周期的7种元素.其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1,Q在元素周期表的各元素中电负性最大.P元素的第三电子层处于全充满状态,第四电子层只有一个电子请回答下列问题:
X、Y、Z、M、N、Q P为元素周期表前四周期的7种元素.其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1,Q在元素周期表的各元素中电负性最大.P元素的第三电子层处于全充满状态,第四电子层只有一个电子请回答下列问题: ,P元素属于ds区元素.
,P元素属于ds区元素.