题目内容
3.下列有关实验操作、现象及结论的叙述正确的是( )| A. | 用钠可以检验某无水酒精中是否含有水 | |
| B. | 140℃时,无水乙醇与浓硫酸共热可制备乙烯 | |
| C. | 制取乙酸乙酯时,试剂加入的顺序是:先加入乙醇,后慢慢加入浓硫酸,最后加入乙酸 | |
| D. | 在蔗糖溶液中加入少量稀硫酸,水浴加热后,再加入少量新制的氢氧化铜悬浊液,加热至沸腾,没有砖红色沉淀生成,说明蔗糖没有水解 |
分析 A.乙醇、水均与Na反应生成氢气;
B.140℃时,无水乙醇与浓硫酸共热发生取代反应生成乙醚;
C.混合时先加密度小的液体,提高乙醇的利用率,最后加乙酸;
D.水解后检验葡萄糖,应在碱性条件下.
解答 解:A.乙醇、水均与Na反应生成氢气,则应选无水硫酸铜检验,故A错误;
B.140℃时,无水乙醇与浓硫酸共热发生取代反应生成乙醚,应加热为170℃发生消去反应,故B错误;
C.混合时先加密度小的液体,提高乙醇的利用率,最后加乙酸,则制取乙酸乙酯时,试剂加入的顺序是:先加入乙醇,后慢慢加入浓硫酸,最后加入乙酸,故C正确;
D.水解后检验葡萄糖,应在碱性条件下,没有加碱至碱性,不能检验,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、制备、检验、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
13.可逆反应mA(s)+nB(g)?eC(g)+fD(g),反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图.下列叙述正确的是( )
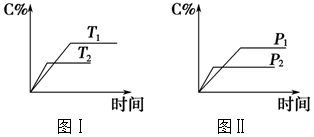

| A. | 化学方程式中m+n<e+f | |
| B. | 达平衡后,若升温,平衡左移 | |
| C. | 达平衡后,加入催化剂则C%增大 | |
| D. | 达平衡后,增加A的量有利于平衡向右移动 |
18.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1L0.5mol/L的FeCl3溶液充分水解后,所得Fe(OH)3胶粒的数目为0.5NA | |
| B. | 将1molNH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA | |
| C. | 室温下,1L pH=1的H2SO4溶液中,由水电离出的H+数目为0.1NA | |
| D. | ag某气体含分子数为b,c g该气体在标况下的体积为$\frac{22.4ab}{c{N}_{A}}$L |
8.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 足量Mg与2.8gN2完全反应后失去0.2NA电子 | |
| B. | 3.0g由葡萄糖和冰醋酸组成的混合物中含有的原子总数为0.3NA | |
| C. | 常温常压下,2.8gC2H4含有共用电子对的数目为0.6NA | |
| D. | 16gO2含有NA个18O原子 |
15.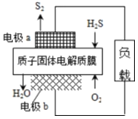 科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫.质子膜H2S燃料电池的结构示意图如图所示.下列说法不正确的是( )
科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫.质子膜H2S燃料电池的结构示意图如图所示.下列说法不正确的是( )
 科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫.质子膜H2S燃料电池的结构示意图如图所示.下列说法不正确的是( )
科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫.质子膜H2S燃料电池的结构示意图如图所示.下列说法不正确的是( )| A. | 电极a为电池的负极 | |
| B. | 电极b上发生的电极反应为:O2+4H++4e-═2H2O | |
| C. | 电路中每流过4 mol电子,在正极消耗44.8LH2S | |
| D. | 每17 g H2S参与反应,有1 mol H+经质子膜进入正极区 |
12.化学在生产生活中有着广泛的应用,下列对应关系错误的是( )
| 选项 | 性质 | 实际应用 |
| A | 蛋白质受热变性 | 用高温加热的方法杀死流感病毒 |
| B | 明矾溶液显酸性 | 用明矾溶液清除铜镜表面的铜锈 |
| C | Na2CO3溶液显碱性 | 用热的纯碱溶液洗去油污 |
| D | P2O5具有吸水性 | 用P2O5干燥氨气 |
| A. | A | B. | B | C. | C | D. | D |
4.在给定条件下,下列选项所示的物质间转化均能实现的是( )
| A. | S$\stackrel{O_{2}、点燃}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | H2SO4(稀)$\stackrel{Cu}{→}$SO2$\stackrel{BaCl_{2}}{→}$BaSO4 | |
| C. | Fe2O3$\stackrel{盐酸}{→}$FeCl3(ap)$\stackrel{蒸发}{→}$无水FeCl3 | |
| D. | SiO2$\stackrel{NaOH}{→}$NaSiO3$\stackrel{HCl}{→}$H2SiO3 |