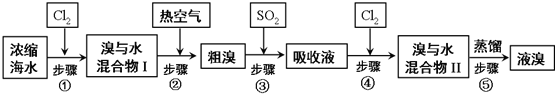
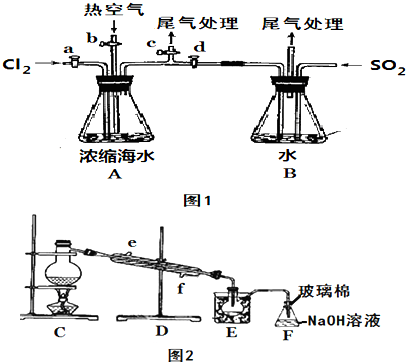
题目内容
19.下列实验不能获得成功的是( )| 选项 | 实验目的 | 实验步骤 |
| A | 探究催化剂对化学反应速率的影响 | 向H2O2溶液中滴加少量FeCl3溶液 |
| B | 探究乙醇能发生氧化反应 | 将铜丝在酒精灯加热后,立即伸入无水乙醇中 |
| C | 探究石蜡油分解的产物不都是烷烃 | 将石蜡油加强热产生的气体通入溴水中 |
| D | 探究浓度对反应速率的影响 | 取少量等质量的相同铁粉,分别加入1mol/L的硫酸和18mol/L的硫酸中,观察现象 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氯化铁能作双氧水分解的催化剂;
B.Cu在空气中加热生成黑色的CuO,CuO和乙醇在加热条件下生成乙醛和Cu;
C.烷烃中不含碳碳不饱和键,所以烷烃不能和溴发生加成反应;
D.常温下,浓硫酸和Fe发生钝化现象.
解答 解:A.氯化铁能作双氧水分解的催化剂,加快双氧水的分解速率,所以所以实现实验目的,故A正确;
B.Cu在空气中加热生成黑色的CuO,CuO和乙醇在加热条件下生成乙醛和Cu,所以可以实现实验目的,故B正确;
C.烷烃中不含碳碳不饱和键,所以烷烃不能和溴发生加成反应,碳碳不饱和烃和溴能发生加成反应而使溴水褪色,所以可以实现实验目的,故C正确;
D.常温下,浓硫酸和Fe发生氧化还原反应生成一层致密的氧化物薄膜而阻止进一步反应,Fe和稀硫酸发生反应生成氢气,所以不能实现实验目的,故D错误;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及化学反应速率影响因素的探究、乙醇的催化氧化、烃的检验等知识点,明确实验原理、物质性质是解本题关键,注意浓硫酸和Fe混合现象,为易错点.

练习册系列答案
相关题目
10.碳酸钠可用于制造玻璃,其俗称是( )
| A. | 小苏打 | B. | 熟石灰 | C. | 生石灰 | D. | 纯碱 |
7.化合物A、B是中学常见的物质,其阴、阳离子只能从表中选择:
(1)若A、B的水溶液均为无色,且A的水溶液呈强酸性,B的水溶液呈强碱性.混合后产生不溶于稀盐酸的白色沉淀及能使湿润的红色石蕊试纸变蓝色的气体.
①B的化学式为Ba(OH)2.
②A、B溶液混合加热反应的离子方程式H++SO42-+NH4++Ba2++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$BaSO4↓+NH3↑+2H2O.
(2)若A的水溶液呈浅绿色,B的水溶液无色且其焰色反应为黄色.向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,但A、B的水溶液混合亦无明显变化.则
①A的化学式为FeI2.
②经分析上述过程中溶液变黄的原因可能有两种(用离子方程式表示)
Ⅰ8H++2NO3-+6I-=2NO↑+3I2+4H2O;Ⅱ8H++2NO3-+6I-=2NO↑+3I2+4H2O和4H++NO3-+3Fe2+=NO↑+3Fe3++2H2O.
③请用一简易方法证明上述溶液变黄的原因取少量变黄溶液于试管中,滴加几滴KSCN溶液,若变红则Ⅱ合理(其他合理亦可).
| 阳离子 | K+、Na+、Fe2+、Ba2+、NH4+、Ca2+ |
| 阴离子 | OH-、NO3-、I-、HCO3-、AlO2-、HSO4- |
①B的化学式为Ba(OH)2.
②A、B溶液混合加热反应的离子方程式H++SO42-+NH4++Ba2++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$BaSO4↓+NH3↑+2H2O.
(2)若A的水溶液呈浅绿色,B的水溶液无色且其焰色反应为黄色.向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,但A、B的水溶液混合亦无明显变化.则
①A的化学式为FeI2.
②经分析上述过程中溶液变黄的原因可能有两种(用离子方程式表示)
Ⅰ8H++2NO3-+6I-=2NO↑+3I2+4H2O;Ⅱ8H++2NO3-+6I-=2NO↑+3I2+4H2O和4H++NO3-+3Fe2+=NO↑+3Fe3++2H2O.
③请用一简易方法证明上述溶液变黄的原因取少量变黄溶液于试管中,滴加几滴KSCN溶液,若变红则Ⅱ合理(其他合理亦可).
4.北京奥运会“祥云”火炬使用的燃料为丙烷.下列关于丙烷的说法正确的是( )
| A. | 分子中的碳原子在一条直线上 | B. | 其一氯代物只有一种 | ||
| C. | 能使酸性高锰酸钾溶液褪色 | D. | 结构简式为CH3 CH2 CH3 |
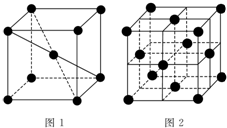 1 183K以下纯铁晶体的基本结构单元如图1所示,1 183K以上转变为图2所示结构的基本结构单元,在1中铁原子的配位数为8;其中为密堆积的是2(填“1”或“2”);1中的空间利用率为68%.
1 183K以下纯铁晶体的基本结构单元如图1所示,1 183K以上转变为图2所示结构的基本结构单元,在1中铁原子的配位数为8;其中为密堆积的是2(填“1”或“2”);1中的空间利用率为68%.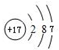 .
.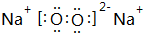 .
.