题目内容
常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了28g,反应中有关物质的物理量正确的是( )
| 二氧化碳 | 碳酸钠 | 转移的电子 | |
| ① | 22.4L | 1mol | |
| ② | 1mol | 1mol | |
| ③ | 106g | 1mol | |
| ④ | 106g | 2mol |
| A、①③ | B、②③ | C、②④ | D、①④ |
考点:化学方程式的有关计算
专题:计算题
分析:由化学方程式:2Na2O2+2CO2═2Na2CO3+O2,根据质量差求出二氧化碳、碳酸钠、氧气的物质的量,根据m=nM计算碳酸钠的质量,结合氧元素化合价比较计算转移电子物质的量,常温常压下,气体摩尔体积大于22.4L/mol,结合V=nVm判断二氧化碳的体积.
解答:
解:参与反应二氧化碳的物质的量为x,生成碳酸钠的物质的量为y,生成氧气物质的量为
2Na2O2+2 CO2═2 Na2CO3+O2 固体质量差
2mol 2mol 1mol 56g
x y z 28g
所以x=
=1mol
y=
=1mol
z=
=0.5mol
常温常压下,气体摩尔体积大于22.4L/mol,故二氧化碳的体积大于22.4L,
碳酸钠的质量=1mol×106g/mol=106g,
氧元素化合价由-1价升高氧气中的0价,转移电子物质的量=0.5mol×2=1mol,
综上可知表中②③正确,
故选B.
2Na2O2+2 CO2═2 Na2CO3+O2 固体质量差
2mol 2mol 1mol 56g
x y z 28g
所以x=
| 2mol×28g |
| 56g |
y=
| 2mol×28g |
| 56g |
z=
| 1mol×28g |
| 56g |
常温常压下,气体摩尔体积大于22.4L/mol,故二氧化碳的体积大于22.4L,
碳酸钠的质量=1mol×106g/mol=106g,
氧元素化合价由-1价升高氧气中的0价,转移电子物质的量=0.5mol×2=1mol,
综上可知表中②③正确,
故选B.
点评:本题考查化学方程式的计算以及氧化还原反应中电子转移数目的计算,注意利用差量法计算,难度中等.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
下列物质中属于弱电解质的是( )
| A、CaCO3 |
| B、O2 |
| C、食盐 |
| D、醋酸 |
在甲、乙两个密闭容器中,分别充入HI、NO2,发生反应:(甲)2HI(g)?H2(g)+I2(g)△H>0,(乙)2NO2(g)?N2O4(g)△H<0.下列措施能使两个容器中混合气体颜色均加深且平衡发生移动的是( )
| A、增大反应物浓度 |
| B、增大压强(减小体积) |
| C、降温 |
| D、加催化剂 |
“神舟”五号载人飞船发射成功后,我国又在启动“嫦娥工程”,在3-4年内中国人登上月球.人类探测月球发现,其土壤中存在较丰富的质量数为3的氦,它可以作为核聚变的重要原料之一.以下叙述正确的是( )
| A、由质量数为3的氦原子构成的分子是双原子分子 |
| B、23He与24He的性质均相同 |
| C、23He中的质子数与24He的中子数相等 |
| D、23He、24He 形成的分子中存在共价键 |
我国首创的海洋电池以铝板、铂网作电极,海水为电解质溶液,空气中的氧气与铝反应产生电流.电池总反应为:4Al+3O2+6H2O=4Al(OH)3,下列判断不正确的是( )
| A、电池工作时,电子由铝板沿导线流向铂网 |
| B、正极反应为:O2+H2O+2e-=2OH- |
| C、铂电极做成网状,可增大与氧气的接触面积 |
| D、该电池通常只需要更换铝板就可继续使用 |
下列溶液与铝不能发生反应产生氢气的是( )
| A、盐酸溶液 |
| B、氢氧化钠溶液 |
| C、氯化铵溶液 |
| D、硫酸钠溶液 |
在以下变化中,加入氧化剂才能实现的是( )
| A、Cl-→Cl2 |
| B、SO42-→BaSO4 |
| C、Cl2→Cl- |
| D、MnO4-→Mn2+ |
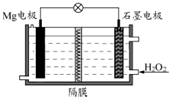 Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )
Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )| A、Mg 电极是该电池的正极 |
| B、H2O2在石墨电极上发生还原反应 |
| C、石墨电极附近溶液的pH 减小 |
| D、溶液中Cl-向正极移动 |