题目内容
我国首创的海洋电池以铝板、铂网作电极,海水为电解质溶液,空气中的氧气与铝反应产生电流.电池总反应为:4Al+3O2+6H2O=4Al(OH)3,下列判断不正确的是( )
| A、电池工作时,电子由铝板沿导线流向铂网 |
| B、正极反应为:O2+H2O+2e-=2OH- |
| C、铂电极做成网状,可增大与氧气的接触面积 |
| D、该电池通常只需要更换铝板就可继续使用 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:根据电池总反应可知,电池工作时,负极为Al,发生氧化反应,电极反应式为Al-3e-+3OH-=Al(OH)3,正极上通入空气,发生还原反应,正极反应式为O2+2H2O+4e-=4OH-,结合原电池的工作原理解答该题.
解答:
解:A、电池工作时,电子由负极流向正极,即从铝电极沿导线流向铂电极,故A正确;
B、正极上通入空气,发生还原反应,正极反应式为O2+2H2O+4e-=4OH-,故B错误;
C、铂做成网状的目的是增大与氧气的接触面积,故C正确;
D、Al不断反应,不断溶解,所以一段时间后,更换铝板就可以继续使用,故D正确.
故选B.
B、正极上通入空气,发生还原反应,正极反应式为O2+2H2O+4e-=4OH-,故B错误;
C、铂做成网状的目的是增大与氧气的接触面积,故C正确;
D、Al不断反应,不断溶解,所以一段时间后,更换铝板就可以继续使用,故D正确.
故选B.
点评:本题考查了原电池原理的应用,题目难度不大,注意原电池的两极上的变化以及电极方程式的书写方法.

练习册系列答案
相关题目
下列有关电化学的叙述正确的是( )
| A、电镀时,镀件接电源的正极,电镀材料接电源负极 |
| B、在船身上装锌块可避免船体遭受腐蚀 |
| C、充电时,把铅蓄电池的负极接在外电源的正极 |
| D、碱性氢氧燃料电池工作时,负极反应为:O2+2H2O+4e-=4OH- |
常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了28g,反应中有关物质的物理量正确的是( )
| 二氧化碳 | 碳酸钠 | 转移的电子 | |
| ① | 22.4L | 1mol | |
| ② | 1mol | 1mol | |
| ③ | 106g | 1mol | |
| ④ | 106g | 2mol |
| A、①③ | B、②③ | C、②④ | D、①④ |
下列常见材料中属于合金的是( )
| A、硬铝 | B、大理石 |
| C、塑料 | D、合成纤维 |
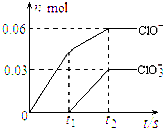 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )| A、反应中转移电子的物质的量是0.21mol |
| B、ClO3-的生成是由于温度升高引起的 |
| C、苛性钾溶液中KOH的质量是16.8g |
| D、氯气被还原成0.06molClO-和0.03molClO3- |
设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A、常温常压下,3.2 g O3所含电子数为1.2 NA |
| B、常温常压下,34g H2O2中含有质子的数目为34 NA |
| C、标准状况下,11.2 L CO与11.2 L O2混合所含原子数为2NA |
| D、0.1 mol CO32-,所含电子数为38NA |
向三份0.1mol?L-1CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、NaCl固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为( )
| A、减小、增大、减小 |
| B、增大、减小、不变 |
| C、减小、增大、不变 |
| D、增大、减小、增大 |