题目内容
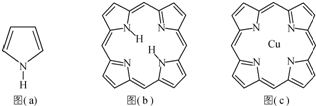
卟吩易与金属离子配位形成金属配合物,卟吩可由甲醛(HCHO)与吡咯[结构式如图(a)所示]合成.
(1)甲醛分子中碳原子轨道杂化类型为 ,HCHO空间构型为 (用文字描述).
(2)1mol吡咯中σ键数目为 .
(3)卟吩分子内存在氢键,在图(b)中用(…)画出氢键结构.
(4)卟吩铜是一种配合物.
①Cu2+基态时核外电子排布式为 .
②在图(c)中画出卟吩铜中Cu2+与N原子间的化学键.
(1)甲醛分子中碳原子轨道杂化类型为
(2)1mol吡咯中σ键数目为
(3)卟吩分子内存在氢键,在图(b)中用(…)画出氢键结构.
(4)卟吩铜是一种配合物.
①Cu2+基态时核外电子排布式为
②在图(c)中画出卟吩铜中Cu2+与N原子间的化学键.

考点:原子轨道杂化方式及杂化类型判断,原子核外电子排布,判断简单分子或离子的构型,配合物的成键情况
专题:原子组成与结构专题,化学键与晶体结构
分析:(1)利用甲醛中的成键来分析碳原子的杂化类型;利用杂化类型来分析空间结构;
(2)共价单键是σ键,共价三键中含有2个π键1个σ键,共价双键中含有1个σ键1个π键;
(3)含F、O、N元素的物质中分子内或分子之间能形成氢键,卟吩分子内存在N元素,1个氮原子有1个孤电子对,以此来解答;
(4)①Cu的原子序数为29,价电子排布为3d104s1;②Cu2+含有空轨道,N原子含有孤对电子,可形成配位键.
(2)共价单键是σ键,共价三键中含有2个π键1个σ键,共价双键中含有1个σ键1个π键;
(3)含F、O、N元素的物质中分子内或分子之间能形成氢键,卟吩分子内存在N元素,1个氮原子有1个孤电子对,以此来解答;
(4)①Cu的原子序数为29,价电子排布为3d104s1;②Cu2+含有空轨道,N原子含有孤对电子,可形成配位键.
解答:
解:(1)甲醛分子中含有碳氧双键,1个甲醛分子中含有2个碳氢σ键,1个碳氧σ键,共有3个σ键,则碳原子轨道的杂化类型为sp2杂化,因甲醛中碳原子采取sp2杂化,则分子的空间构型为平面三角形,
故答案为:sp2;平面三角形;
(2)吡咯分子式为:C4H5N,1个分子中存在1个C-C、2个C-N,2个C=C,4个C-H,1个N-H,含有10个σ键,
故答案为:10 mol(或10×6.02×1023);
(3)因N的电负性较大,则卟吩分子内存在氢键,1个氮原子有1个孤电子对,与1个氢形成分子内氢键,结构如图: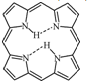 ,
,
故答案为: ;
;
(4)①Cu的原子序数为29,价电子排布为3d104s1,则基态Cu2+的核外电子排布式为1s22s22p63s23p63d9或[Ar]3d9,
故答案为:1s22s22p63s23p63d9或[Ar]3d9;
②Cu2+含有空轨道,1个氮原子有1个孤电子对,可形成配位键,配离子中1个Cu2+与4个N形成配位键,可表示为: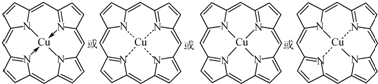 ,
,
故答案为: .
.
故答案为:sp2;平面三角形;
(2)吡咯分子式为:C4H5N,1个分子中存在1个C-C、2个C-N,2个C=C,4个C-H,1个N-H,含有10个σ键,
故答案为:10 mol(或10×6.02×1023);
(3)因N的电负性较大,则卟吩分子内存在氢键,1个氮原子有1个孤电子对,与1个氢形成分子内氢键,结构如图:
 ,
,故答案为:
 ;
;(4)①Cu的原子序数为29,价电子排布为3d104s1,则基态Cu2+的核外电子排布式为1s22s22p63s23p63d9或[Ar]3d9,
故答案为:1s22s22p63s23p63d9或[Ar]3d9;
②Cu2+含有空轨道,1个氮原子有1个孤电子对,可形成配位键,配离子中1个Cu2+与4个N形成配位键,可表示为:
 ,
,故答案为:
 .
.
点评:本题考查物质结构和性质,较为综合,涉及电子排布式的书写、晶胞的结构、杂化类型的判断等知识,是对学生分析、思维能力的考查,注意配合物卟吩铜中Cu2+与N原子间的化学键,题目难度中等.

练习册系列答案
相关题目
人体内含有多种元素,其中许多元素都是人体所需的.但有些元素尚未证实其生理功能,相反,在食品中它们含量稍高会引起中毒反应,食品卫生法对它们的最高标准有极严格的规定.这些元素是( )
①Na ②Mg ③As ④Cd ⑤Ca ⑥Zn ⑦Hg ⑧Pb ⑨Cu ⑩K中的.
①Na ②Mg ③As ④Cd ⑤Ca ⑥Zn ⑦Hg ⑧Pb ⑨Cu ⑩K中的.
| A、⑥⑦⑧⑨ | B、②④⑥⑧ |
| C、③④⑦⑧ | D、②④⑥⑦⑧ |
以1一氯丙烷为主要原料,制取1,2-丙二醇时,需要经过的各反应分别为( )
| A、加成-消去-取代 |
| B、消去-加成-取代 |
| C、取代-消去-加成 |
| D、取代-加成-消去 |
 水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
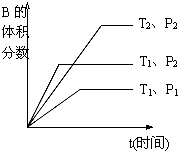 已知某可逆反应mA(g)+nB(g)?qC(g)+pD(s)在密闭容器中进行.如图所示反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线.根据图象填空(注:(2)、(3)、(4)题填“>”、“<”或“=”):
已知某可逆反应mA(g)+nB(g)?qC(g)+pD(s)在密闭容器中进行.如图所示反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线.根据图象填空(注:(2)、(3)、(4)题填“>”、“<”或“=”):