题目内容
11.对下列化学用语的理解和描述均正确的是( )| A. | 电子式 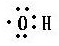 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 | |
| B. | 比例模型  可以表示二氧化碳分子,也可以表示水分子 可以表示二氧化碳分子,也可以表示水分子 | |
| C. | 结构示意图为  的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 | |
| D. | 原子结构示意图 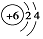 可以表示12C,也可以表示14C 可以表示12C,也可以表示14C |
分析 A.氢氧根离子带一个单位的负电荷;
B.二氧化碳是直线型分子,水分子是V型分子;
C.如果n=16, 为硫离子,硫离子能够破坏水的电离平衡;
为硫离子,硫离子能够破坏水的电离平衡;
D.同位素的质子数、核外电子数相同,中子数不同.
解答 解:A.氢氧根离子的电子式为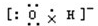 ,羟基的电子式为
,羟基的电子式为 ,故A错误;
,故A错误;
B.二氧化碳是直线型分子,水分子在V型分子,该比例模型是水分子模型,故B错误;
C.结构示意图为 的阴离子中,当n=16时,表示的为硫离子,硫化氢为弱酸,故硫离子能够结合水电离的氢离子,破坏了水的电离平衡,故C错误;
的阴离子中,当n=16时,表示的为硫离子,硫化氢为弱酸,故硫离子能够结合水电离的氢离子,破坏了水的电离平衡,故C错误;
D.同位素的质子数和核外电子数相同,所以其原子结构示意图相同,故D正确;
故选D.
点评 本题考查了电子式、比例模型、原子结构示意图等知识,题目难度中等,注意掌握常见的化学用语的概念及正确的表示方法,明确羟基与氢氧根离子的区别.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案
相关题目
1.下列离子方程式书写不正确的是( )
| A. | 碘化亚铁溶液与少量氯气反应:2I-+Cl2═I2+2Cl- | |
| B. | 少量CO2通入澄清石灰水中:CO2+Ca2++2OH-═CaCO3↓+H2O | |
| C. | 明矾溶液中加氢氧化钡溶液至硫酸根恰好沉淀完全:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O | |
| D. | 向Fe(OH)2中加入稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
2.在任何条件下,纯水显中性,这是因为( )
| A. | pH=7 | B. | c(H +)=c(OH -) | ||
| C. | c(H +)=c(OH -)=10-7mol•L-1 | D. | c(H +)×c(OH-)=10-14 |
19.下列实验仪器中可以直接加热的是( )
| A. | 试管 | B. | 容量瓶 | C. | 量筒 | D. | 冷凝管 |
6.下列离子方程式中正确的是( )
| A. | H2SO4与 Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | Ca(HCO3)2与过量 NaOH 溶液反应:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | Na2CO3溶液中通入少量 CO2:CO32-+CO2+H2O═2HCO3- | |
| D. | CH3COOH 溶液与 NaOH 溶液反应:H++OH-═H2O |
16.下列实验“操作和现象”与“结论”及对应关系均正确的是( )
| 实验操作、现象 | 实验结论 | |
| A | 将FeCl3溶液分别滴入NaBr、NaI溶液中,再分别滴加CCl4,振荡,静置后CCl4层均有颜色 | 氧化性:Fe3+>Br2>I2 |
| B | 向某溶液中加入盐酸酸化的氯化钡溶液,出现白色沉淀 | 该溶液中一定含有大量SO42- |
| C | 将SO2通入溴水中,溴水褪色 | SO2具有漂白性 |
| D | 除锈的铁钉在浓硝酸中浸泡后,用蒸馏水洗净,再放入CuSO4溶液中无现象 | 铁钉表面形成了一层致密稳定的氧化膜 |
| A. | A | B. | B | C. | C | D. | D |
20.在生产、保存、运输和使用浓硫酸时,下列说法不正确的是( )
| A. | 工业制取硫酸过程中生成的SO2可循环使用 | |
| B. | 常温下可选用铁制或铝制容器盛装 | |
| C. | 盛装容器的标签上应标注氧化剂和腐蚀品 | |
| D. | 使用时向其中直接加水可制得稀硫酸 |