题目内容
2.在任何条件下,纯水显中性,这是因为( )| A. | pH=7 | B. | c(H +)=c(OH -) | ||
| C. | c(H +)=c(OH -)=10-7mol•L-1 | D. | c(H +)×c(OH-)=10-14 |
分析 由c(H +)、c(OH-)的相对大小判断溶液的酸碱性,中性时一定存在c(H +)=c(OH-),以此来解答.
解答 解:A.pH=7可能为碱性,如100℃pH=6为中性,故A不选;
B.c(H +)=c(OH -),为中性,故B选;
C.c(H +)=c(OH -),不一定为10-7mol•L-1,常温下等式成立,故C不选;
D.常温下c(H +)×c(OH-)=10-14,不一定为中性,故D不选;
故选B.
点评 本题考查酸碱性的判断,为高频考点,把握酸碱性判断的方法为解答的关键,侧重分析与应用能力的考查,注意氢离子浓度、Kw与温度的关系,题目难度不大.

练习册系列答案
相关题目
12.化学与生产、生活、环境等社会实际密切相关.下列叙述错误的是( )
| A. | 食用植物油的主要成分是高级脂肪酸甘油酯,是人体所需的营养物质 | |
| B. | 汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的 | |
| C. | 金属钠具有强的还原性,可利用钠和熔融TiCl4反应制取金属Ti | |
| D. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,与肺癌等疾病的发生相关 |
17.下列关于化学反应的说法正确的是( )
| A. | 有单质生成的化学反应,一定是氧化还原反应 | |
| B. | 金属单质在氧化还原反应中只能作还原剂 | |
| C. | 有非金属单质参加的化合反应,非金属单质一定是氧化剂 | |
| D. | 有气体生成的化学反应一定是氧化还原反应 |
7.某酸性溶液中只有 Na+、CH3COO-、H+、OH-四种离子.下列描述正确的是( )
| A. | 该溶液可能由等物质的量浓度等体积的 NaOH 溶液和 CH3COOH 溶液混合而成 | |
| B. | 该溶液可能由 pH=3 的 CH3COOH 与 pH=11 的 NaOH 溶液等体积混合而成 | |
| C. | 加入适量 NaOH,溶液中离子浓度为 c(CH3COO- )>c(Na+)>c(OH-)>c(H+) | |
| D. | 加入适量氨水,c(CH3COO-)一定大于 c(Na+)、c(NH4+)之和 |
14.下列说法不正确的是( )
| A. | 干冰可用于人工降雨 | |
| B. | 雷雨时空气中的 N2可变为氮的化合物 | |
| C. | 使用合适的催化剂可将水变成汽油 | |
| D. | 一定条件下石墨能变成金刚石 |
11.对下列化学用语的理解和描述均正确的是( )
| A. | 电子式 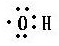 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 | |
| B. | 比例模型  可以表示二氧化碳分子,也可以表示水分子 可以表示二氧化碳分子,也可以表示水分子 | |
| C. | 结构示意图为  的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 | |
| D. | 原子结构示意图 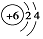 可以表示12C,也可以表示14C 可以表示12C,也可以表示14C |
12.下列物质中,不能由两种单质直接化合得到的是( )
| A. | HCl | B. | Na2O2 | C. | Na2O | D. | FeCl2 |