题目内容
20.在生产、保存、运输和使用浓硫酸时,下列说法不正确的是( )| A. | 工业制取硫酸过程中生成的SO2可循环使用 | |
| B. | 常温下可选用铁制或铝制容器盛装 | |
| C. | 盛装容器的标签上应标注氧化剂和腐蚀品 | |
| D. | 使用时向其中直接加水可制得稀硫酸 |
分析 A.二氧化硫和氧气反应为可逆反应,二氧化硫不能完全转化为三氧化硫;
B.依据浓硫酸的强的氧化性解答;
C.浓硫酸具有强氧化性和腐蚀性;
D.浓硫酸稀释产生的大量的热,结合浓硫酸密度大于水解答.
解答 解:A.二氧化硫和氧气反应为可逆反应,二氧化硫不能完全转化为三氧化硫,未反应的二氧化硫可以循环使用,节约原料,故A正确;
B.浓硫酸具有强的氧化性,常温下能够使铁铝钝化形成致密氧化膜,所以常温下可选用铁制或铝制容器盛装,故B正确;
C.浓硫酸具有强氧化性和腐蚀性,所以盛装容器的标签上应标注氧化剂和腐蚀品,故C正确;
D.浓硫酸稀释产生的大量的热,密度大于水,稀释时应将浓硫酸沿着烧杯壁缓缓注入水中,同时用玻璃棒不断搅拌,故D错误;
故选:D.
点评 本题考查了浓硫酸,明确浓硫酸的相关性质是解题关键,题目难度不大,注意浓硫酸的稀释方法,为常考知识点.

练习册系列答案
相关题目
11.对下列化学用语的理解和描述均正确的是( )
| A. | 电子式 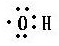 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 | |
| B. | 比例模型  可以表示二氧化碳分子,也可以表示水分子 可以表示二氧化碳分子,也可以表示水分子 | |
| C. | 结构示意图为  的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 | |
| D. | 原子结构示意图 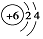 可以表示12C,也可以表示14C 可以表示12C,也可以表示14C |
8.某简易净水器如图所示.下列说法中,正确的是( )
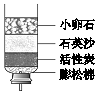

| A. | 净水过程中发生了化学变化 | B. | 该净水器能杀菌消毒 | ||
| C. | 活性炭的主要作用是吸附杂质 | D. | 净化后的水属于纯净物 |
15.侯氏制碱原理:NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl,经过制取氨气、制取NaHCO3、分离及干燥NaHCO3四个步骤,下列图示装置能达到实验目的是( )
| A. |  制取氨气 | B. | 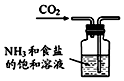 制取NaHCO3 | C. | 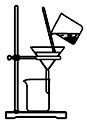 分离NaHCO3 | D. | 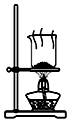 干燥NaHCO3 |
5.下列根据实验现象所得出的结论中,正确的是( )
| A. | 某物质焰色反应呈黄色,说明该物质一定是钠盐 | |
| B. | 某溶液加NaOH溶液生成蓝色沉淀,说明该溶液中一定含有Mg2+ | |
| C. | 某无色溶液中加入BaCl2溶液,有白色沉淀产生,再加稀硝酸,沉淀不消失,说明该溶液中一定含有SO42- | |
| D. | 某溶液中滴加KSCN溶液,溶液不变红,再滴加氯水,变红,说明该溶液中一定含有Fe2+ |
12.下列物质中,不能由两种单质直接化合得到的是( )
| A. | HCl | B. | Na2O2 | C. | Na2O | D. | FeCl2 |
9.下列表示不正确的是( )
| A. | 氯化氢的电子式: | B. | 水分子的结构式:H-O-H | ||
| C. | S2-的结构示意图: | D. | 葡萄糖的分子式:C12H22O11 |
10.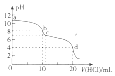 常温下,用0.1mol•L-1的HC1溶液滴定10m L 0.1mol•L-1的Na2CO3溶液,滴定曲线如图所示.下列说法正确的是( )
常温下,用0.1mol•L-1的HC1溶液滴定10m L 0.1mol•L-1的Na2CO3溶液,滴定曲线如图所示.下列说法正确的是( )
 常温下,用0.1mol•L-1的HC1溶液滴定10m L 0.1mol•L-1的Na2CO3溶液,滴定曲线如图所示.下列说法正确的是( )
常温下,用0.1mol•L-1的HC1溶液滴定10m L 0.1mol•L-1的Na2CO3溶液,滴定曲线如图所示.下列说法正确的是( )| A. | 该滴定过程应选择酚酞作指示剂 | |
| B. | a点时,溶液中存在:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) | |
| C. | b点时,溶液中存在:c(CO32-)+c(HCO3-)+c( H2CO3)=0.05 mol•L-1 | |
| D. | d点时,溶液中存在电离平衡:H2CO3?2 H++CO32- |