题目内容
6.下列有关KNO3叙述正确的是( )| A. | 钾离子结构示意图: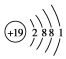 | |
| B. | KNO3溶液中,H+、Na+、Br-、I-能大量共存 | |
| C. | 可用于生产复合肥、配制炸药和制造瓷釉彩药 | |
| D. | KNO3溶液中混有少量NaCl时,可用重结晶的方法提纯,原因是KNO3溶解度大 |
分析 A.K的质子数为19,离子核外电子数为18;
B.离子之间发生氧化还原反应;
C.硝酸钾含N、K元素,可作肥料,硝酸钾具有氧化性;
D.二者溶解度受温度影响不同.
解答 解:A.K的质子数为19,离子核外电子数为18,原子结构示意图、离子结构示意图分别为 ,故A错误;
,故A错误;
B.H+、NO3-、I-发生氧化还原反应,不能共存,故B错误;
C.硝酸钾含N、K元素,可作肥料,硝酸钾具有氧化性,则可用于生产复合肥、配制炸药和制造瓷釉彩药,故C正确;
D.二者溶解度受温度影响不同,则KNO3溶液中混有少量NaCl时,可用冷却结晶法分离,硝酸钾的溶解度受温度影响大,故D错误;
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应、混合物分离方法为解答的关键,侧重分析与应用能力的考查,注意D中分离方法的选择,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.将 AgNO3、Ba(NO3)2、Na2SO4、NaCl 四种电解质按物质的量之比1:1:1:2加入足量蒸馏水中,然后用铂电极电解该混合物至不再有溶质离子参与反应时,则所得氧化产物与还原产物的质量比为( )
| A. | 71:2 | B. | 35.5:108 | C. | 108:35.5 | D. | 71:109 |
1.决定气体摩尔体积大小的主要因素是( )
| A. | 气体分子的大小 | B. | 气体分子数的多少 | ||
| C. | 气体分子间的平均距离 | D. | 气体分子的相对分子质量 |
11.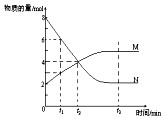 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )| A. | 反应的化学方程式为:N═2M | |
| B. | t2时,反应物和生成物的浓度相等,达到平衡 | |
| C. | 当M、N都是气体时增大压强,N物质的量减少 | |
| D. | 升高温度,平衡常数K增大,则反应的△H<0 |
18.下列说法正确的是( )
| A. | 蔗糖、酒精在水溶液中和熔融态时均不导电,所以它们是非电解质 | |
| B. | SO3、NH3的水溶液均能导电,所以均是电解质 | |
| C. | 钢铁、石墨均导电,所以它们是电解质 | |
| D. | 液态硫酸、固态硫酸钡不能导电,所以二者均不是电解质 |
13.下列两种气体的分子数一定相等的是( )
| A. | 质量不等、密度相等的N2和C2H4 | B. | 等体积等密度的CO和N2 | ||
| C. | 等温等体积的O2和N2 | D. | 等压等体积的N2和CO2 |
完成下列表格(注明单位):
微粒 | 摩尔质量 | 质量 | 物质的量 | 微粒数 |
O | 16g/mol | 16g | ||
N2 | 0.5mol | |||
Cu | 64g/mol | 2NA | ||
H2SO4 | 1.5NA |