题目内容
4.不能用勒沙特列原理解释的是( )| A. | 棕红色的NO2加压后颜色先变深后变浅 | |
| B. | 由氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深 | |
| C. | 增大压强更有利于合成氨 | |
| D. | 硫酸工业上SO2氧化成SO3采用过量的空气 |
分析 勒夏特利原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,勒夏特利原理适用的对象应存在可逆过程,如与可逆过程的平衡移动无关、与平衡移动无关,则不能用勒夏特利原理解释,以此解答该题.
解答 解:A.可逆反应2NO2(g)?N2O4(g),正反应为体积缩小的反应,加压后二氧化氮的浓度增大,所以气体有色加深,由于增大了压强,平衡向生成四氧化二氮的方向移动,故加压后颜色先变深后变浅,可以用平衡移动原理解释,故A不选;
B.反应前后体积相等,增大压强,平衡不移动,但体积减小,浓度增大,与勒沙特列原理无关,故B选;
C.对反应N2(g)+3H2(g)?2NH3(g)△H<0,正反应为气体总物质的量减小的反应,为使氨的产率提高,需要使化学平衡向正反应方向移动,增大压强平衡向着生成氨气的方向移动,能够用勒夏特列原理解释,故C不选;
D.增加氧气的量,氧气浓度增大,则平衡正向移动,所以促进二氧化硫的转化,从而提高二氧化硫转化率,可以用平衡移动原理解释,故D不选;
故选B.
点评 本题考查平衡移动原理,为高频考点,改变条件时只有能引起平衡移动的才能用平衡移动原理解释,否则不能用平衡移动原理解释,注意:平衡移动原理适用范围,题目难度不大.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案
相关题目
1.短周期主族元素X、Y、Z、W原子序数依次增大,其中r(Z)/r(X)(r表示原子半径)的值在短周期主族元素中最大.而W的核外电子总数是同族元素Y的2倍.则下列说法正确的是( )
| A. | 简单离子半径:Z>Y | |
| B. | Z的单质保存在X2Y中 | |
| C. | ZYX溶液和ZXW溶液都呈碱性,且原理相同 | |
| D. | 室温下,0.01mol•L-1W的最高价含氧酸的酸式钠盐溶液的pH为2 |
19.将一定量的镁和铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物只有NO).向反应后的溶液中加入 3mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g.下列叙述不正确的是( )
| A. | 当生成的沉淀量达到最大时,消耗NaOH 溶液的体积V≥100 mL | |
| B. | 当金属全部溶解时,参加反应的硝酸的物质的量一定是 0.4 mol | |
| C. | 参加反应的金属的总质量 9.6g>m>3.6g | |
| D. | 当金属全部溶解时收集到 NO气体的体积一定为2.24L |
9.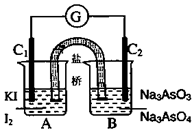 将AsO43-+2I-+2H+?AsO33-+I2+H2O设计成如图所示的电化学装置,其中C1、C2均为石墨棒.甲、乙两组同学分别进行下述操作:
将AsO43-+2I-+2H+?AsO33-+I2+H2O设计成如图所示的电化学装置,其中C1、C2均为石墨棒.甲、乙两组同学分别进行下述操作:
甲组:向B烧杯中逐滴加入浓盐酸
乙组:向B烧杯中逐滴加入40%NaOH溶液
下列描述中,正确的是( )
 将AsO43-+2I-+2H+?AsO33-+I2+H2O设计成如图所示的电化学装置,其中C1、C2均为石墨棒.甲、乙两组同学分别进行下述操作:
将AsO43-+2I-+2H+?AsO33-+I2+H2O设计成如图所示的电化学装置,其中C1、C2均为石墨棒.甲、乙两组同学分别进行下述操作:甲组:向B烧杯中逐滴加入浓盐酸
乙组:向B烧杯中逐滴加入40%NaOH溶液
下列描述中,正确的是( )
| A. | 甲组操作过程中,C1做正极 | |
| B. | 乙组操作过程中,C2做负极,电极反应式为:AsO33-+2e-+2OH-=AsO43-+H2O | |
| C. | 两次操作过程中,微安表(G)指针的偏转方向相反 | |
| D. | 甲组操作时该装置为原电池,乙组操作时该装置为电解池 |
16.交通警察使用的“司机酒后驾车检测器”是应用氧化还原反应原理制成的,其反应的化学方程式为(Cr为铬元素):4CrO3+C2H5OH+6H2SO4=2Cr2(SO4)3+2CO2↑+9H2O CrO3是一种红色固体,它在酸性条件下与酒精蒸气反应生成蓝绿色的硫酸铬,根据颜色变化来判断司机是否饮酒.下列说法不正确的是( )
| A. | CrO3是氧化剂 | |
| B. | 酒精是还原剂 | |
| C. | 当2mol CrO3被还原时,有3mol电子发生转移 | |
| D. | 当0.02mol酒精参与反应时,生成的CO2在标准状况下的体积为0.896L |
14.下列有关化学用于表述正确的是( )
| A. | 质子数和中子数均为6的碳原子${\;}_{6}^{6}$C | |
| B. | 溴化铵的电子式: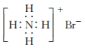 | |
| C. | 氢氧化钠的电子式: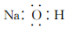 | |
| D. | 2-丙醇的结构简式: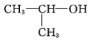 |
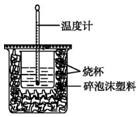 实验室利用如图装置进行中和热的测定.回答下列问题:
实验室利用如图装置进行中和热的测定.回答下列问题: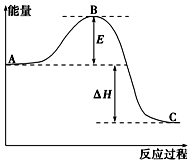 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1. 根据已学物质结构与性质的有关知识,回答下列问题:
根据已学物质结构与性质的有关知识,回答下列问题: