题目内容
10.下列有关溶液中微粒的物质的量浓度关系正确的是( )| A. | 某弱酸的酸式盐NaHA溶液中一定有:c(OH-)+2c(A2-)═c(H+)+c(H2A) | |
| B. | 0.1 mol•L-1CH3COONa 溶液与0.05 mol•L-1盐酸等体积混合后的酸性溶 液中:c(CH3COO-)>c(CH3COOH)>c(Cl-)=c(H+) | |
| C. | 物质的量浓度相等的HCN溶液和NaCN溶液等体积混合后的溶液中:c(CN-)+c(OH-)═c(H+)+c(Na+) | |
| D. | 0.1 mol•L-1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3•H2O)+c(Fe2+)=0.3 mol•L-1 |
分析 A.某弱酸的酸式盐NaHA溶液中存在电荷守恒c(OH-)+2c(A2-)+c(HA-)═c(H+)+c(Na+),物料守恒c(Na+)=c(HA-)+c(A2-)+c(H2A),计算得到;
B.0.1 mol•L-1CH3COONa 溶液与0.05 mol•L-1盐酸等体积混合后,得到同浓度的NaCl、CH3COOH、CH3COONa 溶液,溶液显酸性,则电离大于水解;
C.溶液中阴离子c(CN-)、c(OH-),阳离子为c(H+)、c(Na+),溶液中存在电荷守恒;
D.溶液中存在物料守恒,铵根离子水解生成一水合氨,亚铁离子水解生成氢氧化亚铁.
解答 解:A.某弱酸的酸式盐NaHA溶液中存在电荷守恒c(OH-)+2c(A2-)+c(HA-)═c(H+)+c(Na+),物料守恒c(Na+)=c(HA-)+c(A2-)+c(H2A),计算得到c(OH-)+c(A2-)═c(H+)+c(H2A),故A错误;
B.0.1 mol•L-1CH3COONa 溶液与0.05 mol•L-1盐酸等体积混合后,得到同浓度的NaCl、CH3COOH、CH3COONa 溶液,溶液显酸性,则电离大于水解,溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+),故B错误;
C.溶液中阴离子c(CN-)、c(OH-),阳离子为c(H+)、c(Na+),溶液中存在电荷守恒,c(CN-)+c(OH-)═c(H+)+c(Na+),故C正确;
D.铵根离子水解生成一水合氨,NH4++H2O?NH3•H2O+H+,亚铁离子水解生成氢氧化亚铁,Fe2++2H2O?Fe(OH)2+2H+,溶液中存在物料守恒,c(NH4+)+c(NH3•H2O)+c(Fe2+)+c(Fe(OH)2)=0.3 mol•L-1,故D错误;
故选C.
点评 本题考查离子浓度大小的比较,难度中等,熟悉盐的水解和物料守恒、电荷守恒的相关知识,水解与电离的程度及相互影响是解答本题的关键,注意(NH4)2Fe(SO4)2溶液中物料守恒对氮元素、铁元素存在形式的守恒判断.

| A. | Y、Z形成的化合物为离子化合物 | |
| B. | Y2-的离子半径大于W3+的离子半径 | |
| C. | W的最高价氧化物对应的水化物的酸性比X的强 | |
| D. | Z的气态简单氢化物的稳定性比R的强 |
| 试剂 | 离子反应方程式 | |
| ①Fe(Al) | ||
| ②FeCl 2溶液(FeCl3) |
| A. | 向某溶液中加盐酸,有能使澄清石灰水变浑浊的气体生成,则原溶液中有CO32- | |
| B. | 向某溶液中加石蕊试液,溶液变红,则原溶液中溶质是酸 | |
| C. | 向某溶液中加氢氧化钠溶液,生成蓝色沉淀,则原溶液中有Cu2+ | |
| D. | 向某溶液中加氯化钡溶液,生成白色沉淀,再加盐酸沉淀不溶解,则原溶液中有SO42- |
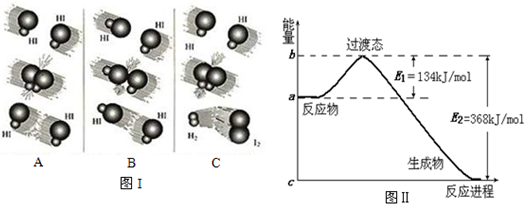
(1)图Ⅰ是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是C(选填“A”、“B”或“C”);
(2)图Ⅱ是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,则写出该反应的热化学方程式NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234 kJ/mol
(3)E1的大小对该反应的反应热有无影响?无.(选填“有”或“无”)
(4)进一步研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关.键能可以简单的理解为断开1mol化学键时所需吸收的能量.如表是部分化学键的键能数据:
| 化学键 | C-H | Cl-Cl | C-Cl | H-Cl |
| 键能/kJ•mol-1 | X | 243 | 330 | 432 |
(5)已知:①C(s)+O2(g)═CO2(g);△H=-393.5kJ•mol-1
②2CO(g)+O2(g)═2CO2(g);△H=-566kJ•mol-1
③TiO2(s)+2Cl2(g)═TiCl4(s)+O2(g);△H=+141kJ•mol-1
则TiO2(s)+2Cl2(g)+2C(s)═TiCl4(s)+2CO(g)的△H=-80KJ/mol.
| A. | 减小C和D的浓度 | B. | 增大D的浓度 | C. | 减小B的浓度 | D. | 增大A和B的浓度 |
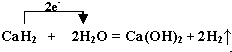 .
.