题目内容
20.金属钙在一定条件下可以与氢气化合生成CaH2(白色固体).将该白色固体加入滴有酚酞的蒸馏水中,可以观察到有气泡生成,溶液变红.请根据以上事实书写CaH2与水反应的化学方程式,并用单线桥标出电子转移方向和数目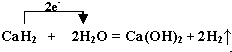 .
.
分析 根据该白色固体加入滴有酚酞的蒸馏水中,可以观察到有气泡生成,溶液变红,说明有碱和气体生成,据此书写方程式,然后根据反应中元素的化合价变化判断转移电子数,再用单线桥标出电子转移方向和数目.
解答 解:因为CaH2加入滴有酚酞的蒸馏水中,可以观察到有气泡生成,溶液变红,说明有碱和气体生成,则方程式为:CaH2+2H2O=Ca(OH)2+2H2↑,反应中转移电子数目为2,CaH2失电子,水得电子,则用单线桥标出电子转移方向和数目为: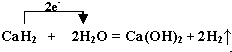 ;
;
故答案为: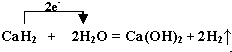 .
.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 某弱酸的酸式盐NaHA溶液中一定有:c(OH-)+2c(A2-)═c(H+)+c(H2A) | |
| B. | 0.1 mol•L-1CH3COONa 溶液与0.05 mol•L-1盐酸等体积混合后的酸性溶 液中:c(CH3COO-)>c(CH3COOH)>c(Cl-)=c(H+) | |
| C. | 物质的量浓度相等的HCN溶液和NaCN溶液等体积混合后的溶液中:c(CN-)+c(OH-)═c(H+)+c(Na+) | |
| D. | 0.1 mol•L-1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3•H2O)+c(Fe2+)=0.3 mol•L-1 |
11.下列说法正确的是( )
| A. | 对于△S>0的反应,若在任何温度下均能自发进行,则该反应△H>0 | |
| B. | 氢氧燃料电池发电,比氢气直接在空气中燃烧发电能量转换率高 | |
| C. | 合成氨反应N2(g)+3H2(g)?2NH3(g)△H<0,加入催化剂能加快反应速率并提高转化率 | |
| D. | Na2S2O3溶液中加入稀盐酸:2S2O32-+2H+═SO42-+3S↓+H2O |
8.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,11.2 L CCl4含有的分子数目为0.5NA | |
| B. | 1 mol Na2O2固体中含离子总数为3NA | |
| C. | 将10mL 1mol•L-1FeCl3溶液滴入沸水中,所得氢氧化铁胶粒数为0.01NA | |
| D. | 0.1 molH2O和D2O组成的混合物中含有中子数是NA |
5.下列有关实验操作的说法正确的是( )
| A. | 利用澄清石灰水可以鉴别Na2CO3和NaHCO3 | |
| B. | 利用激光笔可以检验豆浆是否属于胶体 | |
| C. | 实验室可以用石英坩埚加热固体NaOH | |
| D. | 用托盘天平称取5.85g NaCl到100mL容量瓶,再用适量蒸馏水溶解定容可配制1.0mol/L NaCl溶液 |
12.下列有关实验的说法正确的是( )
| A. | 用干燥的pH试纸测定新制氯水的pH | |
| B. | 中和滴定实验中,洗净后的锥形瓶不需要干燥 | |
| C. | 用Na2S溶液与AlCl3溶液混合制取Al2S3 | |
| D. | 向白色ZnS沉淀上滴加CuSO4溶液,沉淀变为黑色,说明Ksp(ZnS)<Ksp(CuS) |
9.室温下,下列溶液中粒子的物质的量浓度关系正确的是 (?)
| A. | 0.lmol/L NaHS溶液:c(H+)+c(Na+)=c(S2-)+c(HS-)+c(OH-) | |
| B. | 浓度均为0.1 mol/L的 ①NH4Cl ②NH4HSO4③NH4HCO3三种溶液,其中c(NH4+):③>①>② | |
| C. | pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合:c(Na+)=c(CH3COO-)>c(OH-)=c(H+) | |
| D. | 0.lmol/L Na2C03溶液:c(H2CO3)+c(HCO3-)+c(CO32-)=0.lmol/L |