题目内容
15.如图为铜-锌-稀硫酸构成的原电池示意图,下列说法错误的是( )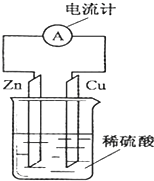
| A. | 电子由铜片通过导线流向锌片 | |
| B. | 铜为正极,铜不易失电子而受到保护 | |
| C. | 锌片为负极,且锌片逐渐溶解 | |
| D. | 该装置能将化学能转变为电能 |
分析 图为铜锌原电池示意图,Zn为负极,Cu为正极,电子从负极流向正极,反应生成硫酸锌和氢气,以此来解答.
解答 解:A.Zn失去电子为负极,逐渐溶解,所以电子由锌片通过导线流向铜片,故A错误;
B.Cu为正极,在Cu电极上氢离子得电子生成氢气,但铜极发生还原反应,铜不易失电子而受到保护,故B正确;
C.Zn为负极,逐渐溶解,故C正确;
D.该装置是原电池,能将化学能转变为电能,故D正确;
故选A.
点评 本题考查原电池,明确原电池的工作原理即可解答,侧重电极、电极反应、电子流向的考查,注重基础知识,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.下列说法不正确的是( )
| A. | 高温结构陶瓷、光导纤维均属于新型无机非金属材料 | |
| B. | 糖类、油脂、蛋白质是人类重要的营养物质 | |
| C. | 煤、石油、天然气均属于可再生的化石燃料 | |
| D. | 塑料、合成纤维、合成橡胶是三大合成材料 |
10.表是元素周期表的一部分.
根据A~G元素在周期表中的位置,用化学式填写空白.
(1)元素中电负性最强的是F,第一电离能最小的是Na.
(2)最高价氧化物对应水化物的酸性最强的酸是HClO4.
(3)D、E、F三种元素按原子半径由大到小的顺序排列为P>N>F.
(4)A的氧化物和B的单质反应后所得溶液的pH>7.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | F | H | |||||
| 3 | B | C | E | G |
(1)元素中电负性最强的是F,第一电离能最小的是Na.
(2)最高价氧化物对应水化物的酸性最强的酸是HClO4.
(3)D、E、F三种元素按原子半径由大到小的顺序排列为P>N>F.
(4)A的氧化物和B的单质反应后所得溶液的pH>7.
20.在标准状况下
①6.72L CH4 ②3.01×1023个HCl分子
③13.6g H2S ④0.2mol NH3
下列对这四种气体的关系从大到小表达正确的是( )
①6.72L CH4 ②3.01×1023个HCl分子
③13.6g H2S ④0.2mol NH3
下列对这四种气体的关系从大到小表达正确的是( )
| A. | 体积 ②>③>④>① | B. | 密度 ②>③>①>④ | ||
| C. | 质量 ②>③>①>④ | D. | 氢原子个数 ②>④>③>① |
4.下列各组物质,按化合物、单质、混合物顺序排列的是( )
| A. | CO2、Fe、HCl | B. | NaOH、液态O2、碘酒 | ||
| C. | 生石灰、白磷、熟石灰 | D. | 空气、氮气、硫酸铜 |
9.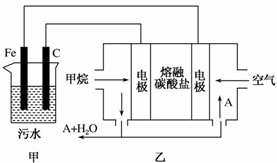 工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.某科研小组用该原理处理污水,设计的装置如图所示.下列说法正确的是( )
工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.某科研小组用该原理处理污水,设计的装置如图所示.下列说法正确的是( )
 工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.某科研小组用该原理处理污水,设计的装置如图所示.下列说法正确的是( )
工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.某科研小组用该原理处理污水,设计的装置如图所示.下列说法正确的是( )| A. | 为了增加污水的导电能力,应向污水中加入适量的H2SO4溶液 | |
| B. | 甲装置中Fe电极的反应为Fe-3e-═Fe3+ | |
| C. | 为了使燃料电池乙长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为CO2 | |
| D. | 当乙装置中有1.6 gCH4参加反应时,C电极理论上生成气体的体积在标况下为4.48 L |
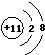 ;D在周期表中位置第三周期第VIA族;E的化学式Na2O2.
;D在周期表中位置第三周期第VIA族;E的化学式Na2O2.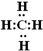 ;
;