题目内容
5.A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和.(1)C离子结构示意图
 ;D在周期表中位置第三周期第VIA族;E的化学式Na2O2.
;D在周期表中位置第三周期第VIA族;E的化学式Na2O2.(2)A、B、D形成的气态氢化物稳定性最强的是H2O(填化学式);A的气态氢化物的电子式
 ;
;(3)A、D两元素形成化合物属共价(填“离子”或“共价”)化合物.
(4)写出D的最高价氧化物的水化物和A反应的化学方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
分析 A、B、C、D为四种短周期元素,原子序数依次增大,B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,则固体E为Na2O2,则B为O元素、C为Na元素;A的原子序数小于B,且A原子的最外层上有4个电子,则A为C元素;D的L层电子数等于K、M两个电子层上电子数之和,则D原子M层电子数为8-2=6,核外各层电子分别为2、8、6,则D为S元素,据此解答.
解答 解:A、B、C、D为四种短周期元素,原子序数依次增大,B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,则固体E为Na2O2,则B为O元素、C为Na元素;A的原子序数小于B,且A原子的最外层上有4个电子,则A为C元素;D的L层电子数等于K、M两个电子层上电子数之和,则D原子M层电子数为8-2=6,核外各层电子分别为2、8、6,则D为S元素,
(1)由上述分析可知,C为Na元素,钠离子的离子结构示意图为 ;D为S元素,在周期表中位于第三周期第VIA族;固体E为Na2O2;
;D为S元素,在周期表中位于第三周期第VIA族;固体E为Na2O2;
故答案为: ;第三周期第VIA族;Na2O2;
;第三周期第VIA族;Na2O2;
(2)A为C元素、B为O元素、D为S元素,形成的气态氢化物稳定性最强的是H2O;C 元素的氢化物为甲烷,其电子式为 ;
;
故答案为: ;
;
(3)A为C元素、D为S元素,二者形成CS2,属于共价化合物;
故答案为:共价;
(4)D为S元素,最高价氧化物的水化物的化学式是H2SO4,浓硫酸与C在加热条件下反应生成二氧化硫、二氧化碳和水,其化学式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
点评 本题是根据原子结构及部分物质性质推断元素种类,再写出相关的结构示意图、电子式、化学方程式等化学用语,注意对基础知识的积累掌握.

| A. | 7.8 g Na2O2中含有的阴离子数等于0.2NA | |
| B. | 0.1 mol 16OD-离子含有的电子、中子数均为1.0NA | |
| C. | 常温常压下,42g乙烯和丁烯混合气体中,极性键数为 6 NA | |
| D. | 密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA |
| A. | 强电解质和弱电解质的本质区别在于:强电解质易溶于水,弱电解质 难溶于水 | |
| B. | 强电解质都是可溶性化合物,弱电解质都是难溶性化合物 | |
| C. | 强电解质的水溶液中无溶质分子,弱电解质的水溶液中有溶质分子 | |
| D. | 强电解质溶液的导电能力强,弱电解质溶液的导电能力弱 |
| A. | 增加炼铁高炉的高度可以降低尾气中CO的含量 | |
| B. | 在元素周期表的金属和非金属分界线附近寻找半导体材料 | |
| C. | 控制实验条件可以改变可逆反应的限度和速率 | |
| D. | 在化工生产中应遵循“绿色化学”的思想 |
| A. | 电子层序数越大,s原子轨道的形状相同,半径越大 | |
| B. | 在同一电子层上运动的电子,其自旋方向肯定不同 | |
| C. | 镁原子由1s22s22p63s2→1s22s22p63p2时,释放能量,由基态转化成激发态 | |
| D. | 杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对 |
| A. | 胶体与溶液的本质区别是丁达尔效应 | |
| B. | 氯化铁溶液可应急止血,利用的是胶体的聚沉 | |
| C. | 用一束平行光线入射淀粉溶液里,从侧面可以观察到一条光亮的通路 | |
| D. | 将稀硫酸逐滴加入氢氧化铁胶体中,开始时产生沉淀,继续滴加时沉淀又溶解 |
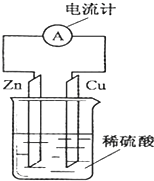
| A. | 电子由铜片通过导线流向锌片 | |
| B. | 铜为正极,铜不易失电子而受到保护 | |
| C. | 锌片为负极,且锌片逐渐溶解 | |
| D. | 该装置能将化学能转变为电能 |
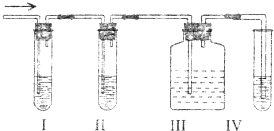 在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2.回答下列问题:
在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2.回答下列问题: