题目内容
15.短周期主族元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为18.X与Y、Z位于相邻周期,Y原子最外层电子数是X原子内层电子数的3倍,下列说法正确的是( )| A. | Y的低价氧化物能使Z单质的水溶液褪色 | |
| B. | X的氢化物溶于水显酸性 | |
| C. | 其离子半径大小:Z>Y>X | |
| D. | X的氢化物和Z的最高价氧化物对应的水化物不能反应生成盐 |
分析 短周期主族元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为18,Y原子最外层电子数是X原子内层电子数的3倍,最外层电子数不超过8个,K层不超过2个,则X内层电子数是2,所以X位于第二周期,Y、Z位于第三周期,Y的最外层电子数为6,则Y为S元素,Z的原子序数大于S,所以Z为Cl元素,三种原子的最外层电子数之和为18,所以X的最外层电子数为5,则X为N元素,据此解答.
解答 解:短周期主族元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为18,Y原子最外层电子数是X原子内层电子数的3倍,最外层电子数不超过8个,K层不超过2个,则X内层电子数是2,所以X位于第二周期,Y、Z位于第三周期,Y的最外层电子数为6,则Y为S元素,Z的原子序数大于S,所以Z为Cl元素,三种原子的最外层电子数之和为18,所以X的最外层电子数为5,则X为N元素,
A、Y为S元素,Y的低价氧化物二氧化硫能使氯气的水溶液褪色,即二氧化硫与氯气反应生成硫酸和盐酸,故A正确;
B、X的氢化物为氨气,氨气和水反应生成一水合氨,在水中电离生成按很离子合氢氧根离子,则溶液显碱性,故B错误;
C、电子层越多,半径越大,电子排布相同时,原子序数越大,离子半径越小,则离子半径大小:Y>Z>X,故C错误;
D、N的氢化物为氨气,Cl的最高价氧化物对应的水化物为高氯酸,二者反应生成高氯酸铵,属于盐,故D错误;
故选A.
点评 本题考查学生利用元素的位置及原子的最外层电子数和内层电子数的关系来推断元素,利用X为第二周期元素为突破口是解答本题的关键,学生应熟悉元素化合物知识来解答此类习题,题目难度中等.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
5.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 4gNaOH固体所含电子总数为2NA | |
| B. | 22.4lL C2H6所含化学键总数为7 NA | |
| C. | 6g SiO2所含分子数为0.1NA,化学键总数为0.4 NA | |
| D. | 0.1 mol•L-1NH4Cl溶液中,NH${\;}_{4}^{+}$与Cl-数之和小于0.2NA |
3.下列的一些说法,不正确的有( )
①焰色反应是化学变化;
②干馏和分馏都属于化学变化;
③单质钠加入氯化镁溶液中制取镁;
④可以用电解熔融的氯化钠的方法来制取金属钠;
⑤用电解法制铝时,原料是氯化铝
⑥石英、玛瑙、水晶、玻璃、水泥、陶瓷、太阳能电池和光纤都是硅酸盐产品.
①焰色反应是化学变化;
②干馏和分馏都属于化学变化;
③单质钠加入氯化镁溶液中制取镁;
④可以用电解熔融的氯化钠的方法来制取金属钠;
⑤用电解法制铝时,原料是氯化铝
⑥石英、玛瑙、水晶、玻璃、水泥、陶瓷、太阳能电池和光纤都是硅酸盐产品.
| A. | ②③④⑤ | B. | ①③⑤⑥ | C. | ①②③⑤⑥ | D. | ①②③④⑤⑥ |
10.图分别表示有关反应的反应过程与能量变化的关系,据此判断下列说法中正确的是( )


| A. | 金刚石转变为石墨是吸热反应 | |
| B. | S(g)+O2(g)═SO2(g)△H1,S(s)+O2(g)═SO2(g)△H2,则△H1>△H2 | |
| C. | 白磷比红磷稳定 | |
| D. | CO(g)+H2O(g)═CO2(g)+H2(g)△H<0 |
20.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 2g氢气所含原子数目为NA | |
| B. | 1.7g NH3中含N-H键数目为0.1NA | |
| C. | 标准状况下,22.4L单质溴所含有的原子数目为2NA | |
| D. | 1molMg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子 |
7. 化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.
化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.
(1)下列△H表示物质燃烧热的是△H4、△H5;表示物质中和热的是△H6.(填“△H1”、“△H2”和“△H3”等)
A.2H2(g)+O2(g)=2H2O(l)△H1
B.C(s)+1/2O2(g)=CO(g)△H2
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H3
D.C(s)+O2(g)=CO2(g)△H4
E.C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)△H5
F.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H6
G.2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H7
(2)已知在101kPa、273K时,15g乙烷燃烧生成CO2和液态水,放出akJ的热量,下列热化学方程式正确的是C.
A.C2H6(g)+$\frac{7}{2}$O2(g)=2CO2(g)+3H2O(l)△H=+2akJ/mol
B.C2H6(g)+$\frac{7}{2}$/2O2(g)=2CO2(g)+3H2O(g)△H=-2akJ/mol
C.2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l)△H=-4akJ/mol
D.2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g)△H=-4akJ/mol
(3)进一步研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关(键能可以简单地理解为断开1mol化学键时所需吸收的能量),如表是部分化学键的键能数据:
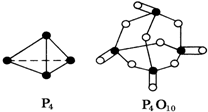
已知白磷(P4)的燃烧热为2378.0kJ/mol,白磷完全燃烧的产物(P4O10)的结构如图所示,则如表中a=433.75.
(4)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ/mol.
 化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.
化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.(1)下列△H表示物质燃烧热的是△H4、△H5;表示物质中和热的是△H6.(填“△H1”、“△H2”和“△H3”等)
A.2H2(g)+O2(g)=2H2O(l)△H1
B.C(s)+1/2O2(g)=CO(g)△H2
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H3
D.C(s)+O2(g)=CO2(g)△H4
E.C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)△H5
F.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H6
G.2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H7
(2)已知在101kPa、273K时,15g乙烷燃烧生成CO2和液态水,放出akJ的热量,下列热化学方程式正确的是C.
A.C2H6(g)+$\frac{7}{2}$O2(g)=2CO2(g)+3H2O(l)△H=+2akJ/mol
B.C2H6(g)+$\frac{7}{2}$/2O2(g)=2CO2(g)+3H2O(g)△H=-2akJ/mol
C.2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l)△H=-4akJ/mol
D.2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g)△H=-4akJ/mol
(3)进一步研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关(键能可以简单地理解为断开1mol化学键时所需吸收的能量),如表是部分化学键的键能数据:
| 化学键 | P-P | P-O | O═O | P═O |
| 键能KJ/mol | 197 | 360 | 499 | a |
(4)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ/mol.
5.下列关于Na2O2的叙述正确的是( )
| A. | Na2O2是淡黄色固体,久置于空气中变成Na2O | |
| B. | Na2O2与水的反应中,Na2O2只作氧化剂 | |
| C. | 用0.1mol Na2O2与足量水反应转移的电子的物质的量为0.2mol | |
| D. | Na2O2放入饱和NaOH溶液中,放出大量的O2,并有白色固体析出 |
 粗铜的电解精炼如图所示.在粗铜的电解过程中,粗铜板应是图中电极c(填图中的字母);在电极d上发生的电极反应式为Cu2++2e-═Cu.
粗铜的电解精炼如图所示.在粗铜的电解过程中,粗铜板应是图中电极c(填图中的字母);在电极d上发生的电极反应式为Cu2++2e-═Cu.