题目内容
11.下列不属于氧化还原反应的是( )| A. | S+O2 $\frac{\underline{\;点燃\;}}{\;}$SO2 | B. | Fe(OH)3+3HCl═FeCl3+3H2O | ||
| C. | 2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C | D. | 4HNO3(浓)$\frac{\underline{\;光照\;}}{\;}$4NO2↑+O2↑+2H2O |
分析 发生的反应中,含元素的化合价变化,则为氧化还原反应;若不含元素的化合价变化,则不属于氧化还原反应,以此来解答.
解答 解:A.在S+O2 $\frac{\underline{\;点燃\;}}{\;}$SO2中,S、O元素的化合价变化,为氧化还原反应,故A不选;
B.Fe(OH)3+3HCl═FeCl3+3H2O中无元素的化合价变化,为非氧化还原反应,故B选;
C.2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C中镁和碳元素的化合价变化,属于氧化还原反应,故C不选;
D.在4HNO3(浓)$\frac{\underline{\;光照\;}}{\;}$4NO2↑+O2↑+2H2O反应,氮和氧元素的化合价变化,为氧化还原反应,故D不选;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握发生的反应及反应中元素的化合价变化为解答关键,侧重氧化还原反应判断的考查,题目难度不大.

练习册系列答案
相关题目
10.生活中的一些小常识往往包含化学知识,以下叙述不正确的是( )
| A. | 用热的纯碱水洗涤油污 | |
| B. | 用食醋消除暖水瓶中的水垢 | |
| C. | 用碘水来检测成熟的苹果中是否含有淀粉 | |
| D. | 纤维素在人体内可水解为葡萄糖,故可作为人类的营养物质 |
19.若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,可能共存的是( )
| A. | NH4+、CO32-、K+、Na+ | B. | Na+、Ba2+、Cl-、HCO3- | ||
| C. | NO3-、Cu2+、K+、SO42- | D. | K+,Na+,Cl-,NO3- |
6.下列物质中,只含离子键的是( )
| A. | O2 | B. | KOH | C. | MgO | D. | CO2 |
16.氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末,微溶于水、不溶于乙醇及稀硫酸,在空气中迅速被氧化成绿色,见光分解变成褐色;如图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程如下:
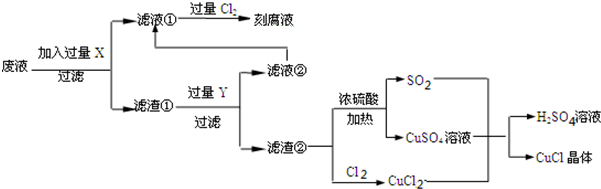
根据以上信息回答下列问题:
(1)该生产过程可以与氯碱工业、硫酸工业生产相结合,现代氯碱工业的装置名称是离子交换膜电解槽_此空删去.
(2)流程中的X是Fe,Y是HCl (均填化学式).
(3)产生CuCl的化学方程式为CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4.
(4)为了提髙CuCl产品的质量,采用抽滤或者减压过滤法快速过滤,析出的CuCl晶体不用水洗涤而用无水乙醇洗涤,其目的是CuCl微溶于水、不溶于乙醇,用乙醇洗涤可减少产品CuCl的损失,生产过程中控制溶液的pH不能过大的原因是溶液pH大会促进CuCl的水解.
(5)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是防止CuCl的氧化和见光分解.
(6)氯化亚铜的定量分析:
①称取样品0.25g 置于预先放入10mL过量的FeCl3溶液250mL的锥形瓶中,不断摇动;
②待样品溶解后,加水50mL、邻菲罗啉指示剂2滴;
③立即用0.10mol•L-1硫酸铈Ce(SO4)2标准溶液滴至绿色出现为终点.同时做空白试验一次.已知:CuCl+FeCl3=CuCl2+FeCl2 Fe2++Ce4+=Fe3++Ce3+,如此再重复二次实验得到以下数据:
(说明:空白试验指在不加试样的情况下按试样分析规程在同样的操作条件下进行的分析,所得结果的数值为空白值)
④数据处理:计算得该工业CuCl的纯度为95%.(平行实验结果相差不能超过0.3%)

根据以上信息回答下列问题:
(1)该生产过程可以与氯碱工业、硫酸工业生产相结合,现代氯碱工业的装置名称是离子交换膜电解槽_此空删去.
(2)流程中的X是Fe,Y是HCl (均填化学式).
(3)产生CuCl的化学方程式为CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4.
(4)为了提髙CuCl产品的质量,采用抽滤或者减压过滤法快速过滤,析出的CuCl晶体不用水洗涤而用无水乙醇洗涤,其目的是CuCl微溶于水、不溶于乙醇,用乙醇洗涤可减少产品CuCl的损失,生产过程中控制溶液的pH不能过大的原因是溶液pH大会促进CuCl的水解.
(5)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是防止CuCl的氧化和见光分解.
(6)氯化亚铜的定量分析:
①称取样品0.25g 置于预先放入10mL过量的FeCl3溶液250mL的锥形瓶中,不断摇动;
②待样品溶解后,加水50mL、邻菲罗啉指示剂2滴;
③立即用0.10mol•L-1硫酸铈Ce(SO4)2标准溶液滴至绿色出现为终点.同时做空白试验一次.已知:CuCl+FeCl3=CuCl2+FeCl2 Fe2++Ce4+=Fe3++Ce3+,如此再重复二次实验得到以下数据:
| 1 | 2 | 3 | |
| 空白试验消耗硫酸铈标准溶液的体积(ml) | 0.75 | 0.50 | 0.80 |
| 0.25克样品消耗硫酸铈标准溶液的体积(ml) | 24.65 | 24.75 | 24.70 |
④数据处理:计算得该工业CuCl的纯度为95%.(平行实验结果相差不能超过0.3%)
1.下列关于物质性质变化的比较,不正确的是( )
| A. | 原子半径大小:Na>S>O | B. | 还原性强弱:F->Cl->Br->I- | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 气态氢化物稳定性:HBr>HCl>HF |