题目内容
2.甲、乙两同学欲分别完成“钠与氯气反应”的实验.Ⅰ.甲同学的方案为:取一块绿豆大的金属钠(切去氧化层),用滤纸吸净煤油,放在石棉网上,用酒精灯微热.待钠熔成球状时,将盛有氯气的集气瓶迅速倒扣在钠的上方(装置如图Ⅰ).该方案的不足之处有钠预先在空气中加热,会生成氧化物,影响钠在氯气中燃烧;实验过程中会产生少量污染(至少答出两点).
Ⅱ.乙同学所采用的装置如图Ⅱ,回答下列问题:
(1)按图Ⅱ组装仪器、添加药品,实验开始后,先将浓盐酸挤入试管,试管中发生反应的离子方程式为2MnO4-+10Cl-+16H+═2Mn2++5Cl2↑+8H2O;待整套装置中出现整个装置充满黄绿色气体(现象)后,点燃酒精灯.
(2)点燃酒精灯后,玻璃管中出现的现象是钠熔化并燃烧,产生黄色火焰,有白烟(至少答出两点).
(3)写出图Ⅱ烧杯中发生反应的离子方程式Cl2+2OH-═Cl-+ClO-+H2O.
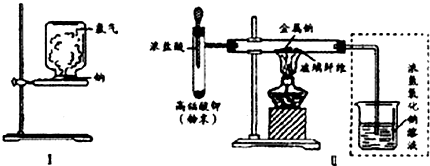
分析 Ⅰ.钠在空气中熔成球状时,易与空气氧气反应生成过氧化钠;
Ⅱ.(1)高锰酸钾具有强氧化性,与浓盐酸反应生成氯气,颜色为黄绿色;
(2)钠熔点低,与氯气反应时,生成NaCl,产生白烟,火焰呈黄色;
(3)氯气与氢氧化钠反应生成氯化钠、次氯酸钠、水.
解答 解:Ⅰ.钠预先在空气中加热,会生成氧化钠,使氯气与钠难以反应,影响钠在氯气中的燃烧,放在石棉网上,用酒精灯微热,当盛有氯气的集气瓶倒扣时,会有少量氯气泄漏,污染环境,
故答案为:钠预先在空气中加热,会生成过氧化物,影响钠在氯气中燃烧;实验过程中会产生少量污染;
Ⅱ.(1)高锰酸钾具有强氧化性,与浓盐酸反应生成氯气,反应的离子方程式为2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O,氯气呈黄绿色,当整个装置充满黄绿色气体时,开始点燃酒精灯,可充分反应,
故答案为:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;整个装置充满黄绿色气体;
(2)钠熔点低,与氯气在加热时剧烈反应,放出大量的热,生成NaCl,产生白烟,火焰呈黄色,
故答案为:钠熔化并燃烧,产生黄色火焰,有白烟;
(3)氯气与氢氧化钠反应生成氯化钠、次氯酸钠、水,离方程式为:Cl2+2OH-═Cl-+ClO-+H2O,
故答案为:Cl2+2OH-═Cl-+ClO-+H2O.
点评 本题考查氯气与钠反应的实验设计,题目难度中等,学习中牢固掌握相关基础知识,把握相关实验操作,则本题不易出错.

练习册系列答案
 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
1.与OH-有相同电子数和质子数的粒子是( )
| A. | F- | B. | Cl- | C. | NH3 | D. | H2O |
2.可以将六种无色液体:C2H5OH、AgNO3溶液,C2H5Br、KI溶液,C6H5OH溶液,C6H6一一区分开的试剂是( )
| A. | HCl溶液 | B. | 溴水 | C. | 酸性KMnO4溶液 | D. | NaOH溶液 |
19.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1molFeCl3水解生成的Fe(OH)3胶粒数为NA | |
| B. | 密闭容器中,28gN2和6gH2充分反应,产物的分子数为2NA | |
| C. | 标准状况下,22.4LCO2与足量Na2O2反应转移的电子数为NA | |
| D. | 50mL18.4mol•L-1浓硫酸与足量Cu共热,生成SO2的分子数为0.46NA |
6.下列对化学反应速率和反应限度的叙述正确的是( )
| A. | 决定化学反应速率的主要因素是光照、超声波、压强和催化剂等 | |
| B. | 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率 | |
| C. | 可逆反应进行到一定程度时,正、逆反应速率相等.各物质浓度也相等 | |
| D. | 生产过程中,化学反应限度是决定原料利用率和产品产率的重要因素之一 |
11.下列不属于氧化还原反应的是( )
| A. | S+O2 $\frac{\underline{\;点燃\;}}{\;}$SO2 | B. | Fe(OH)3+3HCl═FeCl3+3H2O | ||
| C. | 2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C | D. | 4HNO3(浓)$\frac{\underline{\;光照\;}}{\;}$4NO2↑+O2↑+2H2O |
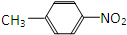 和
和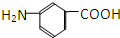 E.35Cl和37Cl
E.35Cl和37Cl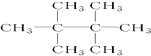 ,
,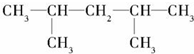 ,该烯烃可能的结构简式有2种.
,该烯烃可能的结构简式有2种.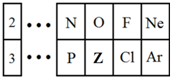 如图是元素周期表的一部分,请回答下列问题.
如图是元素周期表的一部分,请回答下列问题.