题目内容
19.氢能源是一种重要的清洁能源.现有两种可产生H2的化合物甲和乙.将6.00g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72LH2(已折算成标准状况).甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液.化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25g/L.请回答下列问题:
(1)乙的结构式是
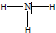 .
.(2)甲与水反应的化学方程式是AlH3+3H2O=Al(OH)3+3H2↑.
(3)气体丙与金属镁反应的产物的化学式是Mg3N2.
(4)乙在加热条件下与CuO 反应可生成Cu和气体丙,写出该反应的化学方程式2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+3H2O+N2↑.
分析 甲加热至完全分解,只得到一种短周期元素的金属单质和6.72L H2,则甲中含有H元素,甲与水反应能产生H2,同时产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液,应为Al(OH)3,综上可知,甲中含有Al和H两种元素,n(H2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,则m(H)=0.3mol×2×1g/mol=0.6g,则6.00g甲中含有m(Al)=6.00g-0.6g=5.4g,n(Al)=$\frac{5.4g}{27g/mol}$=0.2mol,所以n(Al):n(H)=0.2mol:0.6mol=1:3,则甲的化学式为AlH3;
乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状况下的密度为1.25g/L,则丙的相对原子质量为1.25g•L-1×22.4L=28,则丙为N2,则乙为NH3,据此解答.
解答 解:甲加热至完全分解,只得到一种短周期元素的金属单质和6.72L H2,则甲中含有H元素,甲与水反应能产生H2,同时产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液,应为Al(OH)3,综上可知,甲中含有Al和H两种元素,n(H2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,则m(H)=0.3mol×2×1g/mol=0.6g,则6.00g甲中含有m(Al)=6.00g-0.6g=5.4g,n(Al)=$\frac{5.4g}{27g/mol}$=0.2mol,所以n(Al):n(H)=0.2mol:0.6mol=1:3,则甲的化学式为AlH3;
乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状况下的密度为1.25g/L,则丙的相对原子质量为1.25g•L-1×22.4L=28,则丙为N2,则乙为NH3.
(1)乙为氨气,结构式是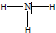 ,故答案为:
,故答案为: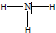 ;
;
(2)甲与水反应的化学方程式是:AlH3+3H2O=Al(OH)3+3H2↑,故答案为:AlH3+3H2O=Al(OH)3+3H2↑;
(3)气体丙与金属镁反应的产物的化学式是:Mg3N2,故答案为:Mg3N2;
(4)乙在加热条件下与CuO 反应可生成Cu和气体丙,该反应的化学方程式:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+3H2O+N2↑,故答案为:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+3H2O+N2↑.
点评 本题考查无机物的推断,属于计算型推断,注意根据反应的现象以及数据判断甲两种物质,侧重考查学生对知识的迁移应用,题目难度中等.

| A. | PCl5 | B. | H2O | C. | CO2 | D. | BF3 |
| A. | R的氧化物一定能溶于水 | |
| B. | R的最高价氧化物对应水化物是H2RO3 | |
| C. | R的氢化物的水溶液呈碱性 | |
| D. | R的氧化物都能与NaOH反应 |
| 实验操作 | 实验目的 | |
| A | 制乙炔时用饱和食盐水代替水 | 加快化学反应速率 |
| B | CH4与SO2混合气体通过盛有溴水的洗气瓶 | 除去中CH4的SO2 |
| C | 甲烷与乙烯的混合气体通过盛有酸性高锰酸钾的洗气瓶 | 除去甲烷中的乙烯 |
| D | 将浓硫酸、乙醇混合加入试管中,加热,然后将导管末端插入酸性KMnO4溶液中,观察现象; | 检验是否有乙烯生成 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 39K+和40Ca2+微粒中的电子数和中子数都相等 | |
| B. | D2和He在同温同压时,若体积相等,则质量相等 | |
| C. | 同一元素的各种同位素的物理性质、化学性质均不相同 | |
| D. | 两个质量数和电子数都相等的微粒不一定是同种元素 |
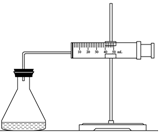 实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应.
实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应.| 实验编号 试剂 | A | B | C |
| 10% H2O2/mL | 20.0 | V1 | V2 |
| 2mol/L FeCl3/mL | 0 | 5.0 | 10.0 |
| H2O/mL | V3 | V4 | 0 |
(1)欲用如图装置来比较该反应的反应速率快慢,如何检查装置气密性:将注射器活塞向外拉出一段,过一会后活塞回到原位,说明气密性良好.
(2)当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测相同时间内收集的气体体积或收集相同体积的气体需要的时间计算反应速率.
(3)为实现实验目的,则V1=20.0,V2=20.0;V3=10.0,V4=5.0.
(4)根据你所掌握的知识判断,在上述实验中反应速率最快的可能是C(填“实验编号”)
(5)已知Fe3+催化H2O2分解的机理可分两步反应进行,其中第一步反应为:2Fe3++H2O2═2Fe2++O2↑+2H+,则第二步反应的离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O.
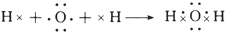 .
.
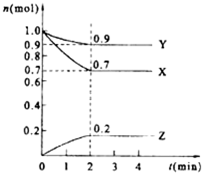 某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示. 2Z;
2Z;