题目内容
16.下列各组离子中,在碱性溶液中能大量共存,且溶液为无色透明的是( )| A. | K+、MnO4-、Cl-、SO42- | B. | Na+、AlO2-、Cl-、SO42- | ||
| C. | SO42-、Fe3+、HCO3-、Ba2+ | D. | Mg2+、NO3-、NH4+、SO42- |
分析 碱性溶液中含大量的氢氧根离子,根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应、水解等,则离子大量共存,并结合离子的颜色来解答.
解答 解:A.MnO4-为紫色,与无色不符,故A不选;
B.碱性溶液中该组离子之间不反应,可大量共存,且离子均为无色,故B选;
C.Fe3+、HCO3-相互促进水解,SO42-、Ba2+结合生成沉淀,不能共存,故C不选;
D.碱性溶液中不能大量存在Mg2+、NH4+,故D不选;
故选B.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、水解反应的判断,题目难度不大.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
6.下列说法中正确的是( )
| A. | 3s2表示3s能级有两个轨道 | |
| B. | 处于最低能量的原子叫做基态原子 | |
| C. | 同一原子中,1s、2s、3s电子的能量逐渐减小 | |
| D. | 同一原子中,3d、4d、5d能级的轨道数依次增多 |
7.锌电池可代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应是2Zn+O2═2ZnO.下列有关它的说法不正确的是( )
| A. | 锌为电池负极,发生氧化反应 | |
| B. | 电池工作时,氧气与锌直接化合,生成氧化锌 | |
| C. | 正极发生的反应是:$\frac{1}{2}$O2+2e-+2H+═H2O | |
| D. | 负极发生的反应是:Zn-2e-+H2O═ZnO+2H+ |
8.“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )
| A. | 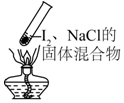 加热时,上部汇聚了固体碘,说明碘的热稳定性较差 | |
| B. | 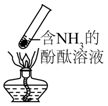 加热时,中部溶液变红,冷却后又变为无色 | |
| C. | 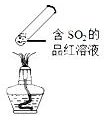 加热时,中部溶液变红,冷却后又变为无色 | |
| D. |  \加热时,上部汇聚了白色固体,说明氯化铵易升华 |
5.将铁粉和铜粉的均匀混合物,平均分为四等分,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量表如表(设硝酸的还原产物只有NO)
试计算:
(1)硝酸的浓度.
(2)每份金属混合物的总质量.
(3)实验④中V的值.
| 编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/ml | 100mL | 200mL | 300mL | 400mL |
| 剩余金属/g | 18.0g | 9.6g | 0 | 0 |
| NO体积/L | 2.24L | 4.48L | 6.7L | V |
(1)硝酸的浓度.
(2)每份金属混合物的总质量.
(3)实验④中V的值.
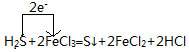 .
.
 ,HCN中C的化合价为-2.
,HCN中C的化合价为-2.