题目内容
7.锌电池可代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应是2Zn+O2═2ZnO.下列有关它的说法不正确的是( )| A. | 锌为电池负极,发生氧化反应 | |
| B. | 电池工作时,氧气与锌直接化合,生成氧化锌 | |
| C. | 正极发生的反应是:$\frac{1}{2}$O2+2e-+2H+═H2O | |
| D. | 负极发生的反应是:Zn-2e-+H2O═ZnO+2H+ |
分析 根据总反应Zn+$\frac{1}{2}$O2═ZnO中化合价变化可知Zn被氧化,作原电池的负极,负极上锌失电子发生氧化反应,正极上氧气得电子发生还原反应,若电解质为酸性,正极电极反应为:$\frac{1}{2}$O2+2e-+2H+═H2O,总反应减去正极得到负极反应:Zn-2e-+H2O═ZnO+2H+,以此解答该题.
解答 解:A.锌失去电子化合价升高,发生氧化反应作原电池负极,故A正确;
B.锌在负极失电子发生氧化反应,氧气在正极得到电子发生还原反应,所以电池工作时,氧气不是与锌直接化合,故B错误;
C.正极上氧气得电子被还原,电极反应为:$\frac{1}{2}$O2+2e-+2H+═H2O,故C正确;
D.锌在负极失电子发生氧化反应,电极反应为:Zn-2e-+H2O═ZnO+2H+,故D正确;
故选B.
点评 本题考查了原电池知识,为高频考点,侧重于学生的分析能力的考查,注意根据电池反应判断原电池的正负极以及电极反应,注意电解质溶液酸碱性的判断,并结合选项做出判断.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.某有机物的结构简式如图所示,有关该有机物的叙述不正确的是( )


| A. | 在一定条件下,能发生取代、氧化、酯化反应 | |
| B. | 1 mol该物质最多可与2 molNa反应 | |
| C. | 1 mol该物质最多可与4 mol H2发生加成反应 | |
| D. | 1 mol该物质完全氧化最多可消耗13 mol氧气 |
18.下列有关Na2CO3和NaHCO3性质的比较中,正确的是( )
| A. | 分别同时滴入等浓度的盐酸,放出气体NaHCO3比Na2CO3快 | |
| B. | 热稳定性Na2CO3<NaHCO3 | |
| C. | 常温时水溶性Na2CO3<NaHCO3 | |
| D. | 相对分子质量Na2CO3<NaHCO3 |
15.除去下列物质中所含的少量杂质(括号中的物质)所选用的试剂和装置均正确的是( )
Ⅰ.试剂:①KMnO4/H+②NaOH溶液 ③饱和Na2CO3溶液 ④H2O ⑤生石灰 ⑥浓溴水
Ⅱ:装置:
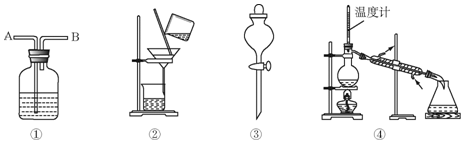
Ⅰ.试剂:①KMnO4/H+②NaOH溶液 ③饱和Na2CO3溶液 ④H2O ⑤生石灰 ⑥浓溴水
Ⅱ:装置:

| 选项 | 物质 | 试剂 | 装置 |
| A | C2H6(C2H4) | ① | ① |
| B | 苯(苯酚) | ⑥ | ② |
| C | 苯(苯甲酸) | ⑤ | ④ |
| D | 甲苯(二甲苯) | ③ | ③ |
| A. | A | B. | B | C. | C | D. | D |
2.下列各组的电极材料和电解液,不能组成原电池的是( )
| A. | 铁片、石墨棒,稀硫酸 | B. | 铜片、石墨棒,硝酸银溶液 | ||
| C. | 锌片、铜片,稀盐酸 | D. | 铜片、银片,CuSO4溶液 |
12.下列各组物质中,互为同位素的是( )
| A. | D2O和H2O | B. | SO3和SO2 | C. | O3和O2 | D. | 235U和238U |
16.下列各组离子中,在碱性溶液中能大量共存,且溶液为无色透明的是( )
| A. | K+、MnO4-、Cl-、SO42- | B. | Na+、AlO2-、Cl-、SO42- | ||
| C. | SO42-、Fe3+、HCO3-、Ba2+ | D. | Mg2+、NO3-、NH4+、SO42- |
 (1)为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将100g样品加热使其质量不再变化,其质量变为96.9%,则该样品的纯度(质量分数)是91.6%
(1)为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将100g样品加热使其质量不再变化,其质量变为96.9%,则该样品的纯度(质量分数)是91.6%