题目内容
1.配平下列条件下的离子反应方程式(1)向含有1mol的明矾溶液中加入含有1molBa(OH)2的溶液3Ba2++6OH-+3SO42-+2Al3+=3BaSO4↓+2Al(OH)3↓;
(2)向含有2molFeBr2的溶液中通入2molCl22Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-;
(3)向含有3molFeI2的溶液中通入5molCl24I-+2Fe2++3Cl2 =2I2+2Fe3++6Cl-;
(4)SO2与酸性KMnO4的离子反应方程式5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+;
(5)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为2Fe3++2I-=2Fe2++I2;
(6)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料.FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
(7)实验室可由软锰矿(主要成分为MnO2)制备K2MnO4,方法如下:软锰矿和过量的固体KOH和KClO3在高温下生成锰酸钾(K2MnO4)和KCl;软锰矿制备K2MnO4的离子方程式是3MnO2+6OH-+ClO3-$\frac{\underline{\;高温\;}}{\;}$3MnO42-+Cl-+3H2O;
(8)K2Cr2O7能与热的稀硫酸酸化的Na2C2O4反应,生成Cr3+和CO2,该反应的离子反应方程式是Cr2O72-+3C2O42-+14H+=2Cr3++6CO2↑+7H2O;
(9)在酸性溶液中IO3-能被I-还原生成碘单质,在碱性溶液中IO3-不能被I-还原,而无论在酸性或碱性溶液中IO4-都能被I-还原,在IO4-与I-的碱性溶液的反应产物中加入淀粉溶液,溶液变蓝,已知IO4-倍还原化合价逐步降低的,在碱性条件溶液中IO4-与I-反应的离子方程式:IO4-+2I-+H2O=IO3-+I2+2OH-.
分析 (1)明矾溶液参加反应的离子Al3+、SO42-,Ba(OH)2的溶液参加反应的离子是Ba2+、OH-,参加反应的溶液中含有1molAl3+、2molSO42-、1molBa2+、2molOH-,Ba(OH)2是少量,根据”少定多变“规则书写;
(2)还原性Fe2+>Br-,先反应2Fe2++Cl2=2Fe3++2Cl-,后反应2Br-+Cl2 =Br2+2Cl-,根据物质的量之比等于化学计量数之比关系书写总反应的离子方程式;
(3)还原性I->Fe2+,先发生2I-+Cl2 =I2+2Cl-,后反应2Fe2++Cl2=2Fe3++2Cl-,根据物质的量之比等于化学计量数之比关系书写总反应的离子方程式;
(4)SO2与酸性KMnO4反应属于氧化还原反应,先确定反应物SO2和MnO4-,产物Mn2+和SO42-,根据化合价升降相等把上述四种物质配平,然后根据电荷守恒确定产物4H+,最后根据元素守恒,确定反应物2H2O;
(5)棕色物质为I2,参加反应的离子为Fe3+和I-,产物为Fe2+和I2,根据化合价升降相等配平;
(6)Fe3+→FeO42-,铁元素化合价升高,确定氯元素化合价降低ClO-→Cl-,根据化合价升降相等把上述四种物质配平,然后根据电荷守恒确定反应物10OH-,最后根据元素守恒,确定产物5H2O;
(7)反应中化合价变化的元素为Mn、Cl,Mn元素由+4价升高为+6,Cl元素化合价由+5降低为-1,根据化合价升降相等,则二氧化锰与氯酸根离子的物质的量之比为3:1,再根据原子守恒配平;
(8)根据得失电子守恒把氧化剂、还原剂、氧化产物、还原产物配平,再根据电荷守恒和原子守恒确定反应物或产物;
(9)由题目信息可知,IO4-被还原时化合价是逐步降低,碱性溶液中IO3-离子不被I-离子还原,故碱性溶液中IO4-离子与I-反应生成碱性溶液中IO3-离子与I2,据此结合守恒判断其它物质生成,配平书写.
解答 解:(1)明矾溶液参加反应的离子Al3+、SO42-,Ba(OH)2的溶液参加反应的离子是Ba2+、OH-,含有1molAl3+、2molSO42-、1molBa2+、2molOH-,Ba(OH)2是少量,反应产物为1molBaSO4、$\frac{2}{3}$molAl(OH)3,因此离子方程式为Ba2++2OH-+SO42-+$\frac{2}{3}$Al3+=BaSO4↓+$\frac{2}{3}$Al(OH)3↓,即3Ba2++6OH-+3SO42-+2Al3+=3BaSO4↓+2Al(OH)3↓,
故答案为:3Ba2++6OH-+3SO42-+2Al3+=3BaSO4↓+2Al(OH)3↓;
(2)2Fe2++Cl2=2Fe3++2Cl- (先反应)
2 1
2mol 1mol
此时剩余2mol-1mol=1molCl2,
2Br-+Cl2 =Br2+2Cl-(后反应)
2 1
2mol 1mol
实际参加反应的Fe2+、Br-、Cl2的物质的量都是2mol,
总的反应关系为2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-,
2 2 2
2mol 2mol 2mol
故答案为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-;
(3)2I-+Cl2 =I2+2Cl-(先反应)
2 1
6mol 3mol
2Fe2++Cl2=2Fe3++2Cl-(后反应)
2 1
3mol 1.5mol
实际参加反应的Fe2+、I-、Cl2的物质的量分别为3mol、6mol、4.5mol,
所以总反应为4I-+2Fe2++3Cl2 =2I2+2Fe3++6Cl-,
4 2 3
6mol 3mol 4.5mol
故答案为:4I-+2Fe2++3Cl2 =2I2+2Fe3++6Cl-;
(4)SO2与酸性KMnO4反应属于氧化还原反应,
①确定已知反应物和产物,得SO2+MnO4-→Mn2++SO42-,
②根据化合价升降相等,得5SO2+2MnO4-→2Mn2++5SO42-,
③根据电荷守恒,结合酸性溶液,确定产物缺少4个正电荷(即为4H+),得5SO2+2MnO4-→2Mn2++5SO42-+4H+,
④根据元素守恒,确定反应物2H2O,得5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+,
故答案为:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+;
(5)棕色物质为I2,参加反应的离子为Fe3+和I-,产物为Fe2+和I2,得Fe3++I--Fe2++I2,
根据化合价升降相等配平,得2Fe3++2I-=2Fe2++I2,
故答案为:2Fe3++2I-=2Fe2++I2;
(6)①确定已知反应物和产物,得Fe3++ClO-→FeO42-+Cl-,
②根据化合价升降相等,得2Fe3++3ClO-→2FeO42-+3Cl-,
③根据电荷守恒,结合强碱性条件下反应,确定反应物缺少10个负电荷(即为10OH-),得2Fe3++3ClO-+10OH-→2FeO42-+3Cl-,
④根据元素守恒,确定产物5H2O,得2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,
故答案为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
(7)由软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl,反应中化合价变化的元素为Mn、Cl,Mn元素由+4价升高为+6,Cl元素化合价由+5降低为-1,根据化合价升降相等,则二氧化锰与氯酸钾的物质的量之比为3:1,再根据原子守恒配平方程式为:3MnO2+6OH-+ClO3- $\frac{\underline{\;高温\;}}{\;}$3MnO42-+Cl-+3H2O,
故答案为:3MnO2+6OH-+ClO3- $\frac{\underline{\;高温\;}}{\;}$3MnO42-+Cl-+3H2O;
(8)①确定已知反应物和产物,Cr2O72-+C2O42-+H+→Cr3++CO2+H2O,
②根据化合价升降相等,Cr2O72-+3C2O42-+H+→2Cr3++6CO2+H2O,
③根据电荷守恒、原子守恒,得Cr2O72-+3C2O42-+14H+=2Cr3++6CO2↑+7H2O,
故答案为:Cr2O72-+3C2O42-+14H+=2Cr3++6CO2↑+7H2O;
(9)由题目信息可知,IO4-被还原时化合价是逐步降低,碱性溶液中IO3-离子不被I-离子还原,故碱性溶液中IO4-离子与I-反应生成碱性溶液中IO3-离子与I2,反应中IO4-→IO3-,I元素化合价共降低2价,2I-→I2+2OH-,I元素化合价共升高2价,故,IO4-的系数为1,I-的系数为2,IO3-的系数为1,I2的系数为1,根据电荷守恒,故还原OH-生成,系数为2,故离子方程式为:IO4-+2I-+H2O=IO3-+I2+2OH-,
故答案为:IO4-+2I-+H2O=IO3-+I2+2OH-.
点评 本题考查离子方程式的书写,为高考热点,主要涉及多步反应计算、氧化还原反应的配平,注意守恒思想的运用和解题方法步骤的总结,题目难度中等.

 快捷英语周周练系列答案
快捷英语周周练系列答案| A. | c(CO32-)的大小关系为:②>⑤>③>④>① | |
| B. | 将溶液蒸干灼烧后只有①不能得到对应的固体物质 | |
| C. | ③④⑤既能与盐酸反应,又能与NaOH溶液反应 | |
| D. | c(HCO3-)的大小关系为:④>③>⑤>②>① |
| A. | 2H2(g)+O2(g)=2H2O(g)△H 1; 2H2(g)+O2(g)=2H2O(l)△H2 | |
| B. | S(s)+O2(g)=SO2(g)△H 1; S(g)+O2(g)=SO2(g)△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H 1; C(s)+O2(g)=CO2(g)△H2 | |
| D. | H2(g)+Cl2(g)=2HCl(g)△H 1; $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g)△H2 |
| A. | C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol | B. | 2SO2(g)+O2(g)=SO3(g)△H=-196.6kJ/mol | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol | D. | 2H2(g)+O2(g)=2H2O(l)△H=-517.6kJ/mol |
| 化学键 | H-H | Cl-Cl | H-Cl |
| 键能 | 436kJ/mol | 243kJ/mol | 431kJ/mol |
| A. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g)△H=-91.5kJ/mol | |
| B. | H2(g)+Cl2(g)═2HCl(g)△H=-183kJ/mol | |
| C. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g)△H=+91.5kJ/mol | |
| D. | 2HCl(g)═H2(g)+Cl2(g)△H=+183 kJ/mol |
| A. | Na2O、CaO、Al2O3均为碱性氧化物 | |
| B. | 水玻璃、漂白液、液氯均为混合物 | |
| C. | 氨水能够导电,所以氨水是电解质 | |
| D. | 有单质参加或生成的化学反应不一定是氧化还原反应 |
 )是合成天然橡胶的单体.请回答下列问题:
)是合成天然橡胶的单体.请回答下列问题: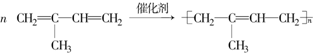 ,该反应类型为加聚反应.
,该反应类型为加聚反应.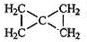 .
. .
.