题目内容
16.在同温同压下,下列各组热化学方程式中,△H2>△H 1的是( )| A. | 2H2(g)+O2(g)=2H2O(g)△H 1; 2H2(g)+O2(g)=2H2O(l)△H2 | |
| B. | S(s)+O2(g)=SO2(g)△H 1; S(g)+O2(g)=SO2(g)△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H 1; C(s)+O2(g)=CO2(g)△H2 | |
| D. | H2(g)+Cl2(g)=2HCl(g)△H 1; $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g)△H2 |
分析 A.液态水变为气态水的过程是吸热过程;
B.固体硫变为气态硫需要吸收热量;
C.碳单质完全燃烧放热多于不完全燃烧放的热.
D.化学反应方程式的系数加倍,焓变数值加倍.
解答 解:A.物质的燃烧反应是放热的,所以焓变是负值,液态水变为气态水的过程是吸热的,则生成液态水放热多,故△H1>△H2,故A错误;
B.物质的燃烧反应是放热的,所以焓变是负值,固体硫变为气态硫需要吸收热量,则气态硫燃烧放热多,所以△H1>△H2,故B错误;
C.碳单质完全燃烧生成二氧化碳放热多于不完全燃烧生成一氧化碳放的热,反应的焓变是负值,故△H1>△H2,故C错误;
D.化学反应方程式的系数加倍,焓变数值加倍,该化合反应是放热的,所以焓变值是负值,△H1=2△H2,则△H1<△H2,故D正确;
故选D.
点评 本题考查了化学反应与能量、反应热与物质状态的关系,题目难度不大,注意反应热与物质的计量数、状态、产物等有关系,侧重于考查学生的分析能力和应用能力.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目
6.SO2的防治与利用对于环境保护意义重大.某小组在实验室中对SO2的性质及回收利用等相关问题进行探究.
(1)用图1装置制备纯净的SO2,发生装置中反应的化学方程式为2NaHSO3+H2SO4═Na2SO4+2H2O+2SO2↑或NaHSO3+H2SO4═NaHSO4+H2O+SO2↑,装置的连接顺序为:a→b→c→g→f→d(按气流方向,用小写字母表示).
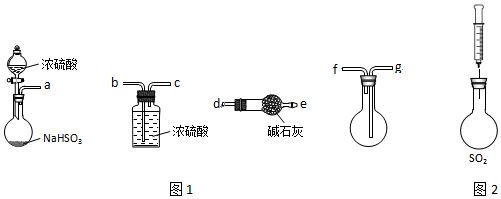
(2)用图2装置探究SO2的性质.限选试剂:NaOH溶液、稀H2SO4、H2O2溶液、FeCl3溶液、淀粉-KI溶液、新制H2S溶液
(3)工业上回收利用SO2的一种途径是:SO2$→_{步骤Ⅰ}^{氨水}$(NH4)2SO3$→_{步骤Ⅱ}^{空气}$(NH4)2SO4,
该小组在实验室探究步骤Ⅱ时,一定条件下向100mL c0mol•L-1的(NH4)2SO3溶液通入空气后,欲测定溶液中(NH4)2SO3的氧化率(α).
①为该小组设计实验方案(不必描述操作过程的细节,物理量的数值用字母表示):
方案1:取20.00mL反应后的溶液于锥形瓶中,用浓度为Cmol/L酸性高锰酸钾溶液滴定,重复滴定三次,平均消耗高锰酸钾的体积为VmL;方案2:向反应后的溶液中加入过量的盐酸,再加入足量的氯化钡溶液,将沉淀过滤、洗涤、干燥、称量,质量为mg.
②α=$\frac{8{C}_{0}-CV}{8{C}_{0}}$或$\frac{m}{23.3{C}_{0}}$×100%(用实验方案中的物理量表示).
(1)用图1装置制备纯净的SO2,发生装置中反应的化学方程式为2NaHSO3+H2SO4═Na2SO4+2H2O+2SO2↑或NaHSO3+H2SO4═NaHSO4+H2O+SO2↑,装置的连接顺序为:a→b→c→g→f→d(按气流方向,用小写字母表示).

(2)用图2装置探究SO2的性质.限选试剂:NaOH溶液、稀H2SO4、H2O2溶液、FeCl3溶液、淀粉-KI溶液、新制H2S溶液
| 操作步骤 | 实验现象 | 解释原因 |
| 用注射器将新制H2S溶液注入充满SO2的烧瓶 | 产生乳白色浑浊 | +4价S有①氧化性 |
| 用注射器将 ②FeCl3溶液溶液注入充满SO2的烧瓶 | ③溶液由棕黄色变成浅绿色 | +4价S有还原性,反应的离子方程式为④2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
该小组在实验室探究步骤Ⅱ时,一定条件下向100mL c0mol•L-1的(NH4)2SO3溶液通入空气后,欲测定溶液中(NH4)2SO3的氧化率(α).
①为该小组设计实验方案(不必描述操作过程的细节,物理量的数值用字母表示):
方案1:取20.00mL反应后的溶液于锥形瓶中,用浓度为Cmol/L酸性高锰酸钾溶液滴定,重复滴定三次,平均消耗高锰酸钾的体积为VmL;方案2:向反应后的溶液中加入过量的盐酸,再加入足量的氯化钡溶液,将沉淀过滤、洗涤、干燥、称量,质量为mg.
②α=$\frac{8{C}_{0}-CV}{8{C}_{0}}$或$\frac{m}{23.3{C}_{0}}$×100%(用实验方案中的物理量表示).
7.NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,NA个H2和O2的混合气体的体积约为22.4 L | |
| B. | 1mol SiO2晶体中,含有2NA个Si-O键 | |
| C. | 0.1 mol Cl2溶解于一定体积的水中,转移电子数为0.2NA | |
| D. | 标准状况下,11.2 L H2O所含分子数为0.5 NA |
4.用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1L1 mol•L-1硫酸中所含的氧原子数为4NA | |
| B. | 标准状况下,11.2LCCl4所含的原子数为2.5NA | |
| C. | 2.3gNa中所含的电子数为1.1NA | |
| D. | 常温常压下,14g由N2与CO组成对混合气体中所含对原子数为2NA |
11.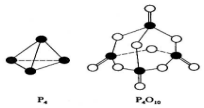 白磷与氧可发生如下反应:P4+5O2=P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P akJ•mol-1、P-O bkJ•mol-1、P=O ckJ•mol-1、O=O dkJ•mol-1.根据图示的分子结构和有关数据估算生成1mol P4O10时,反应的能量变化正确的是( )
白磷与氧可发生如下反应:P4+5O2=P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P akJ•mol-1、P-O bkJ•mol-1、P=O ckJ•mol-1、O=O dkJ•mol-1.根据图示的分子结构和有关数据估算生成1mol P4O10时,反应的能量变化正确的是( )
 白磷与氧可发生如下反应:P4+5O2=P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P akJ•mol-1、P-O bkJ•mol-1、P=O ckJ•mol-1、O=O dkJ•mol-1.根据图示的分子结构和有关数据估算生成1mol P4O10时,反应的能量变化正确的是( )
白磷与氧可发生如下反应:P4+5O2=P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P akJ•mol-1、P-O bkJ•mol-1、P=O ckJ•mol-1、O=O dkJ•mol-1.根据图示的分子结构和有关数据估算生成1mol P4O10时,反应的能量变化正确的是( )| A. | 吸收(6a+5d-4c-12b)kJ热量 | B. | 放出(4c+12b-6a-5d)kJ热量 | ||
| C. | 吸收(4c+12b-4a-5d)kJ热量 | D. | 放出(4a+5d-4c-12b)kJ热量 |
8.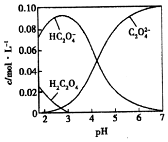 H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
 H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定正确的是( )| A. | pH=2.5的溶液中:c(H2C2O4)+c(C2O42-)>c(HC2O4-) | |
| B. | c(Na+)=0.100 mol•L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-) | |
| C. | c(HC2O4-)=c(C2O42-)的溶液中:c(Na+)>0.100 mol•L-1+c(HC2O4-) | |
| D. | pH=7.0的溶液中:c(Na+)=2(C2O42-) |
5.苯甲醛(微溶于水、易溶于有机溶剂,密度月等于水的密度)在碱性条件下发生歧化反应可以制备苯甲醛(在水中溶解度不大,易溶于有机溶剂,密度约等于水的密度)、苯甲酸.反应原理如下:
2C6H5CHO+NaOH→C6H5CH2OH+C6H5COONa
C6H5CCOONa+HCl→C6H5 COOH+NaCl
相关物质物理性质如表:
实验流程如图:

(1)第Ⅰ步需连续加热1小时(如图1),其中加热混合固定装置为画出.

仪器A的名称为三颈烧瓶(或三口烧瓶),若将仪器B改为仪器C,效果不如B,说明原因:B的接触面积大,冷却回流苯甲醛的效果好
(2)操作②有关分液漏斗的使用不正确的是CD
A.分液漏斗在使用之前必须检验矢耦漏水
B.分液漏斗内的液体不能过多,否则不利于振荡
C.充分振荡后将分液漏斗置于铁架台上静置,分层后立即打开旋塞进行分液
D.分液时待下层液体放完后立即关闭旋塞,换掉烧杯再打开旋塞使上层液体流下
(3)操作③是用沸水浴加热蒸馏,再进行操作④(如图2),收集℃的馏分.图2中有一处明显错误,正确的应改为温度计的水银球处于蒸馏烧瓶的支管口
(4)抽滤时(如图3)烧杯中苯甲酸晶体转入布氏漏斗时,杯壁上还粘有少量晶体,用滤液 冲洗杯壁上残留的晶体.抽滤完成后用少量冰水对晶体进行洗涤,洗涤应关小水龙头.
(5)用电子天平准确称取0.2440g苯甲酸于锥形瓶中加100mL蒸馏水溶解(必要时可以加热),再用0.1000mol/L的标准氢氧化钠溶液滴定,共消耗标准氢氧化钠溶液19.20mL,苯甲酸的纯度为96.00%.
2C6H5CHO+NaOH→C6H5CH2OH+C6H5COONa
C6H5CCOONa+HCl→C6H5 COOH+NaCl
相关物质物理性质如表:
| 苯甲醛 | 苯甲醇 | 苯甲酸 | 苯 | |
| 沸点/℃ | 178 | 205 | 249 | 80 |
| 熔点/℃ | 26 | -15 | 122 | 5.5 |
| 苯甲酸在水中的溶解度 | ||
| 17℃ | 25℃ | 100℃ |
| 0.21g | 0.34g | 5.9g |

(1)第Ⅰ步需连续加热1小时(如图1),其中加热混合固定装置为画出.

仪器A的名称为三颈烧瓶(或三口烧瓶),若将仪器B改为仪器C,效果不如B,说明原因:B的接触面积大,冷却回流苯甲醛的效果好
(2)操作②有关分液漏斗的使用不正确的是CD
A.分液漏斗在使用之前必须检验矢耦漏水
B.分液漏斗内的液体不能过多,否则不利于振荡
C.充分振荡后将分液漏斗置于铁架台上静置,分层后立即打开旋塞进行分液
D.分液时待下层液体放完后立即关闭旋塞,换掉烧杯再打开旋塞使上层液体流下
(3)操作③是用沸水浴加热蒸馏,再进行操作④(如图2),收集℃的馏分.图2中有一处明显错误,正确的应改为温度计的水银球处于蒸馏烧瓶的支管口
(4)抽滤时(如图3)烧杯中苯甲酸晶体转入布氏漏斗时,杯壁上还粘有少量晶体,用滤液 冲洗杯壁上残留的晶体.抽滤完成后用少量冰水对晶体进行洗涤,洗涤应关小水龙头.
(5)用电子天平准确称取0.2440g苯甲酸于锥形瓶中加100mL蒸馏水溶解(必要时可以加热),再用0.1000mol/L的标准氢氧化钠溶液滴定,共消耗标准氢氧化钠溶液19.20mL,苯甲酸的纯度为96.00%.
6.用单质铁去除酸性水体中NO3-的原理如图所示,下列说法错误的是( )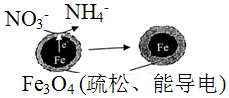

| A. | 能量转化形式主要为化学能转化为电能 | |
| B. | 电极材料分别为Fe和Fe3O4 | |
| C. | 负极反应为:NO3-+8e-+l0H+═NH4++3H2O | |
| D. | 该原理的总反应可表示为:NO3-+3Fe+2H++H2O═NH4++Fe3O4 |