题目内容
16.下列关于硫及其化合物的说法正确的是( )| A. | 浓硫酸滴入胆矾中,胆矾失水变白,发生了化学变化 | |
| B. | 二氧化硫能使溴水褪色,体现二氧化硫的漂白性 | |
| C. | 浓硫酸与灼热的木炭反应,体现浓硫酸的强氧化性和酸性 | |
| D. | 加热时硫与铜反应生成黑色的硫化铜 |
分析 A.浓硫酸具有吸水性,蓝色硫酸铜晶体被浓硫酸吸水,转化为白色硫酸铜粉末属于化学变化;
B.二氧化硫具有还原性,二氧化硫与溴水发生氧化还原反应生成氢溴酸和硫酸;
C.参加反应的浓硫酸化合价不变的部分体现酸性,化合价降低的部分体现强氧化性;
D.硫磺与变价金属反应得到低价态硫化物.
解答 解:A.蓝色硫酸铜晶体被浓硫酸吸水转化为白色硫酸铜粉末,反应为:CuSO4•5H2O$\frac{\underline{\;浓硫酸\;}}{\;}$CuSO4+5H2O,属于化学变化,故A正确;
B.二氧化硫具有还原性,与溴水发生氧化还原反应生成氢溴酸和硫酸,使溴水褪色,硫元素化合价升高,体现还原性,故B错误;
C.C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,该反应中S元素化合价由+6价变为+4价,C元素化合价由0价变为+4价,所以浓硫酸只作氧化剂,故C错误;
D.铜具有可变化合价,与硫磺反应生成硫化亚铜,故D错误;
故选A.
点评 本题考查物质的性质,掌握相关元素化合物的性质是解答本题的关键,题目难度不大.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
7.将下列物质分别加到湿的红色布条上,不能使其褪色是( )
| A. | 新制氯水 | B. | 液氯 | ||
| C. | 次氯酸钠溶液和HCl混合液 | D. | 氯化钙 |
4.表中括号内物质是杂质,试将除杂试剂及分离方法填入表内:
| 混合物 | SiO2 (Si) | CO2(SO2) | NaHCO3(Na2SiO3) | SiO2(NaCl) |
| 除杂试剂 | 空气 | 饱和碳酸氢钠溶液 | 水、足量二氧化碳 | 水 |
| 除杂方法 | 加热 | 洗气 | 过滤、蒸发 | 过滤 |
11.已知1gH2完全燃烧生成水蒸气放出热量为121kJ,有关数据如下:O=O(键能为496kJ•mol-1)、H-H(键能为436kJ•mol-1),试求H2O(g)中H-O键的键能为( )
| A. | 463kJ•mol-1 | B. | 926kJ•mol-1 | C. | 1852kJ•mol-1 | D. | 920kJ•mol-1 |
1.三种短周期元素X、Y、Z,X最外层只有一个不成对电子,Y的次外层为2个电子,最外层有2对成对电子,Z的全部核外电子有2对成对电子和3个不成对电子,则三种元素所组成的化合物中哪是不可能的?( )
| A. | XZY3 | B. | X3Z | C. | XZY2 | D. | X2ZY |
8.某温度下将Cl2通入KOH溶液里,反应后得到KCl、KClO、KClO3的混合溶液.若Cl2与KOH溶液反应时,被还原与被氧化的Cl的物质的量之比是11:3,则生成的KClO与KClO3物质的量之比是( )
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 2:1 |
5.下列各组物质之间,一定是互为同系物的是( )
| A. | HCHO与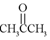 | B. | HOCH2CH3与CH3COOH | ||
| C. | HCOOH与C5H11COOH | D. | C2H4与C3H6 |
6.镁铁合金6.8g溶于300mL2mol/L的盐酸,在标准状况下放出气体的体积为5.6L,向反应后的溶液中加入足量氨水,产生沉淀的质量为( )
| A. | 5.1g | B. | 10.2g | C. | 13.6g | D. | 15.3g |