题目内容
14.常温下,下列说法错误的是( )| A. | pH=6的NaHSO4溶液:c(Na+)+c(H+)=2c(SO42-)+c(OH-) | |
| B. | 0.1 mol/L NaHCO3溶液加水稀释后,c(H+)与c(OH-)的乘积不变 | |
| C. | pH相同的①CH3COONa、②NaClO二种溶液的c(Na+):①<② | |
| D. | 0.1 mol/L Na2SO3溶液:c(Na+)=2c(SO32-)+2c(HSO3-)+2c(H2SO3) |
分析 A.根据电荷守恒分析;
B.c(H+)与c(OH-)的乘积为Kw,Kw只与温度有关;
C.NaClO的水解程度大于CH3COONa,pH相同时,NaClO的浓度较小;
D.根据物料守恒分析.
解答 解:A.pH=6的NaHSO4溶液阴离子所带负电荷总数等于阳离子所带正电荷总数,则:c(Na+)+c(H+)=2c(SO42-)+c(OH-),故A正确;
B.c(H+)与c(OH-)的乘积为Kw,Kw只与温度有关,所以0.1 mol/L NaHCO3溶液加水稀释后,c(H+)与c(OH-)的乘积不变,故B正确;
C.NaClO的水解程度大于CH3COONa,pH相同时,NaClO的浓度较小,则二种溶液的c(Na+):①>②,故C错误;
D.0.1 mol/L Na2SO3溶液中Na的总浓度等于S的总浓度的2倍,则:c(Na+)=2c(SO32-)+2c(HSO3-)+2c(H2SO3),故D正确.
故选C.
点评 本题考查离子浓度大小比较,题目难度中等,本题注意根据题目信息判断,反应后溶质的量及电离、水解的大小,结合电荷守恒和物料守恒解答.

练习册系列答案
相关题目
4.下列说法不正确的是( )
| A. | 工业用焦炭在高温下还原二氧化硅制得高纯硅 | |
| B. | SiO2可用于制造光导纤维 | |
| C. | 钠是一种强还原剂,可以把钛、锆、铌等从其熔融盐中置换出来 | |
| D. | 氧化镁熔点高达250℃,是优质的耐高温材料 |
5.在常温下,取浓度相同的NaOH和HCl溶液,以3:2的体积比相混合(体积变化忽略不计),所得溶液的pH等于13,则原溶液的浓度为( )
| A. | 0.01mol•L-1 | B. | 0.05mol•L-1 | C. | 0.017mol•L-1 | D. | 0.50mol•L-1 |
2.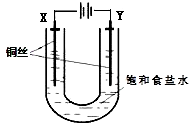 已知:Ksp(CuCl,白色)=1.2×10-6,Ksp(CuOH,橙黄色)=1.2×10-14.如图,用铜电极电解饱和食盐水时,阳极发生的电极反应为Cu-e-+Cl-═CuCl.下列说法不正确的是( )
已知:Ksp(CuCl,白色)=1.2×10-6,Ksp(CuOH,橙黄色)=1.2×10-14.如图,用铜电极电解饱和食盐水时,阳极发生的电极反应为Cu-e-+Cl-═CuCl.下列说法不正确的是( )
 已知:Ksp(CuCl,白色)=1.2×10-6,Ksp(CuOH,橙黄色)=1.2×10-14.如图,用铜电极电解饱和食盐水时,阳极发生的电极反应为Cu-e-+Cl-═CuCl.下列说法不正确的是( )
已知:Ksp(CuCl,白色)=1.2×10-6,Ksp(CuOH,橙黄色)=1.2×10-14.如图,用铜电极电解饱和食盐水时,阳极发生的电极反应为Cu-e-+Cl-═CuCl.下列说法不正确的是( )| A. | Y极发生的电极反应2H2O+2e-═2OH-+H2↑ | |
| B. | 实验开始时,X极附近出现白色浑浊 | |
| C. | 一段时间后,U形管底部形成橙黄色沉淀 | |
| D. | 电解时,Cl-移向Y极 |
6.在含有Fe3+、Fe2+、Al3+、NH4+的稀溶液中加入足量Na2O2固体,充分作用后,再加入过量稀盐酸,完全反应,则离子数目没有变化的是( )
| A. | Fe3+、Al3+ | B. | Fe3+ | C. | Fe2+、NH4+ | D. | Al3+ |
3.关于有机物 的下列叙述中,正确的是( )
的下列叙述中,正确的是( )
 的下列叙述中,正确的是( )
的下列叙述中,正确的是( )| A. | 它的系统名称是2,4-二甲基-4-戊烯 | |
| B. | 它的分子中最多有5个碳原子在同一平面上 | |
| C. | 它与甲基环己烷互为同分异构体 | |
| D. | 有机物的一氯取代产物共有4种 |
2.将0.02molNa分别投入到盛有100mL水、100 mL 1mol•L-1盐酸、100mL 1mol•L-1硫酸铜溶液的X、Y、Z三个烧杯中,下列有关说法错误的是( )
| A. | 三个烧杯中一定均会发生的离子反应有:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 三个烧杯中钠均在液面上剧烈反应 | |
| C. | Z烧杯中一定会有沉淀生成,但沉淀不是单质铜 | |
| D. | 三个烧杯中生成氢气的物质的量相同 |