题目内容
13.下列各项操作中,不会发生“先产生沉淀,然后沉淀又溶解”现象的是( )①向饱和碳酸钠溶液中通入过量的CO2; ②向NaAlO2溶液中逐滴加入过量的稀盐酸,
③向AlC13溶液中逐滴加入过量的稀氢氧化钠溶液; ④向Na2SiO3溶液中通入过量的CO2.
| A. | ①② | B. | ①④ | C. | ①③ | D. | ②③ |
分析 ①二氧化碳和碳酸钠反应生成碳酸氢钠,碳酸氢钠的溶解度小于碳酸钠的溶解度;
②偏铝酸钠和盐酸反应生成氢氧化铝和氯化钠,氢氧化铝和盐酸反应生成氯化铝和水;
③向AlC13溶液中逐滴加入过量的稀氢氧化钠溶液,先生成氢氧化铝沉淀,后沉淀溶解生成偏铝酸钠;
④向Na2SiO3溶液中通入过量的CO2生成硅酸和碳酸氢钠.
解答 解:①向饱和碳酸钠溶液中通入过量的CO2,碳酸钠和二氧化碳、水反应生成碳酸氢钠,碳酸氢钠的溶解性小于碳酸钠的溶解性,原碳酸钠溶液是饱和溶液,生成碳酸氢钠后溶液变成过饱和溶液,所以会析出部分碳酸氢钠晶体,所以不出现“先产生沉淀,然后沉淀又溶解”现象;
②向NaAlO2胶体中逐滴加入过量的稀盐酸,偏铝酸钠先和盐酸反应生成难溶性的氢氧化铝,氢氧化铝是两性氢氧化物能溶于强酸溶液,所以氢氧化铝和盐酸能继续反应生成可溶性的氯化铝,所以出现“先产生沉淀,然后沉淀又溶解”现象;
③向AlC13溶液中逐滴加入过量的稀氢氧化钠溶液,先生成氢氧化铝沉淀,后沉淀溶解生成偏铝酸钠,所以出现“先产生沉淀,然后沉淀又溶解”现象;
④向Na2SiO3溶液中通入过量的CO2生成硅酸和碳酸氢钠,沉淀不会溶解.
故选B.
点评 本题考查的是能发生“先沉淀后溶解”现象的小型综合题,涉及的知识点较多,难度中等,根据物质的性质结合方程式分析本题即可.

练习册系列答案
相关题目
3.下列物质中不属于电解质的是( )
| A. | NaOH | B. | SO2 | C. | H2SO4 | D. | KNO3 |
4.下列说法不正确的是( )
| A. | 工业用焦炭在高温下还原二氧化硅制得高纯硅 | |
| B. | SiO2可用于制造光导纤维 | |
| C. | 钠是一种强还原剂,可以把钛、锆、铌等从其熔融盐中置换出来 | |
| D. | 氧化镁熔点高达250℃,是优质的耐高温材料 |
1.二甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良环保性能;二甲醚(CH3OCH3)是一种无色气体,具有轻微的醚香味,其燃烧热△H=一1455KJ/mol;以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.下列叙述正确是( )
| A. | 二甲醚分子中既含有极性键又含有非极性键 | |
| B. | 二甲醚与乙醛是同分异构体 | |
| C. | 在二甲醚构成的燃料电池中,每消耗0.5mol二甲醚可以向外电路提供6 mol e- | |
| D. | 二甲醚燃烧的热化学方程式表示为:CH3OCH3(g)+3O2(g)═2CO2(g)+3H2O(g)△H=-1455kJ/mol |
8.下列方程式书写正确的是( )
| A. | NaHSO4在水溶液中的电离方程式:NaHSO4═Na++HSO4- | |
| B. | H2SO3的电离方程式:H2SO3?2H++SO32- | |
| C. | CaCO3的电离方程式:CaCO3═Ca2++CO32- | |
| D. | CO32-的水解方程式:CO32-+2H2O?H2CO3+2OH- |
5.在常温下,取浓度相同的NaOH和HCl溶液,以3:2的体积比相混合(体积变化忽略不计),所得溶液的pH等于13,则原溶液的浓度为( )
| A. | 0.01mol•L-1 | B. | 0.05mol•L-1 | C. | 0.017mol•L-1 | D. | 0.50mol•L-1 |
2.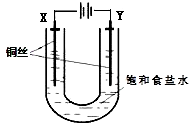 已知:Ksp(CuCl,白色)=1.2×10-6,Ksp(CuOH,橙黄色)=1.2×10-14.如图,用铜电极电解饱和食盐水时,阳极发生的电极反应为Cu-e-+Cl-═CuCl.下列说法不正确的是( )
已知:Ksp(CuCl,白色)=1.2×10-6,Ksp(CuOH,橙黄色)=1.2×10-14.如图,用铜电极电解饱和食盐水时,阳极发生的电极反应为Cu-e-+Cl-═CuCl.下列说法不正确的是( )
 已知:Ksp(CuCl,白色)=1.2×10-6,Ksp(CuOH,橙黄色)=1.2×10-14.如图,用铜电极电解饱和食盐水时,阳极发生的电极反应为Cu-e-+Cl-═CuCl.下列说法不正确的是( )
已知:Ksp(CuCl,白色)=1.2×10-6,Ksp(CuOH,橙黄色)=1.2×10-14.如图,用铜电极电解饱和食盐水时,阳极发生的电极反应为Cu-e-+Cl-═CuCl.下列说法不正确的是( )| A. | Y极发生的电极反应2H2O+2e-═2OH-+H2↑ | |
| B. | 实验开始时,X极附近出现白色浑浊 | |
| C. | 一段时间后,U形管底部形成橙黄色沉淀 | |
| D. | 电解时,Cl-移向Y极 |
3.关于有机物 的下列叙述中,正确的是( )
的下列叙述中,正确的是( )
 的下列叙述中,正确的是( )
的下列叙述中,正确的是( )| A. | 它的系统名称是2,4-二甲基-4-戊烯 | |
| B. | 它的分子中最多有5个碳原子在同一平面上 | |
| C. | 它与甲基环己烷互为同分异构体 | |
| D. | 有机物的一氯取代产物共有4种 |