题目内容
7.(1)同温同压下,一定体积的气态氢化物HmX的质量是等体积NH3的2倍,则X的相对原子质量为34m(用含m的代数式表示).(2)a个X原子的总质量为bg,则X的相对原子质量可表示为$\frac{b}{a}{N}_{A}$.
(3)20g A物质和14g B物质完全反应,生成8.8g C物质、3.6g D物质和0.2mol E物质,则E物质的摩尔质量为108g/mol.
分析 (1)同温同压下,密度之比等于相对分子质量之比,据此计算H2X的相对分子质量,进而计算X的相对原子质量;
(2)根据a个X原子的总质量为bg,求出1molX原子的质量,即可解得;
(3)根据质量守恒可计算E的质量,结合M=$\frac{m}{n}$计算摩尔质量.
解答 解:(1)相同状况下,一定体积的气态氢化物HmX的质量是等体积NH3的2倍,则二者密度之比为2:1,同温同压下,密度之比等于相对分子质量之比,HmX的相对分子质量为17×2=34,则X的相对原子质量为34m,
故答案为:34m;
(2)a个X原子的总质量为b g,则NA个原子的质量为$\frac{b}{a}{N}_{A}$,即X原子的摩尔质量为$\frac{b}{a}{N}_{A}g/mol$,所以相对原子质量为$\frac{b}{a}{N}_{A}$,故答案为:$\frac{b}{a}{N}_{A}$.
(3)化学反应遵循质量守恒定律,则应有m(A)+m(B)=m(C)+m(D)+m(E),
则m(E)=20g+14g-8.8g-3.6g=21.6g,
M(E)=$\frac{21.6g}{0.2mol}$=108g/mol,故答案为:108g/mol.
点评 本题考查物质的量的计算,题目难度不大,本题注意从质量守恒定律的运用和公式的掌握.

练习册系列答案
相关题目
17.1L 1mol/L 氨水中,含有( )
| A. | 1 mol NH3 分子 | B. | NH3和NH4+ 总共1 mol | ||
| C. | NH3•H2O 1 mol | D. | NH3•H2O、NH3、NH4+ 总共1 mol |
18.下列物质中,各元素原子的最外层电子全部参加成键的是( )
| A. | 氟化氢 | B. | 水 | C. | 硅化氢 | D. | 二氧化碳 |
15.发射“天宫一号”使用的燃料是偏二甲肼(用符号R表示),同时用四氧化二氮为氧化剂,两种物质混合便会剧烈燃烧,产生大量气体并释放出大量的热,该反应的化学方程式为:2N2O4+R→3N2+2CO2+4H2O,则R的化学式是( )
| A. | C3H5O | B. | C2H8N2 | C. | C2H8 | D. | C2H5N |
2.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1 L 1 mol•L-1 K2SO4溶液中含有的钾离子数为2NA | |
| B. | 1mol氯气完全反应生成氯离子得到的电子数为NA | |
| C. | 22 g CO2中含有的分子数为NA | |
| D. | 常温常压下,22.4 L N2中含有的分子数为NA |
12.下列说法正确的是( )
| A. | 酸性氧化物一定是非金属氧化物 | B. | 碱性氧化物一定是金属氧化物 | ||
| C. | 氧气和臭氧是氧元素的不同核素 | D. | H2 D2 T2 互为同位素 |
19.设NA为阿佛加德罗常数,下列叙述中正确的是( )
| A. | 46 g NO2 和 N2O4混合气体中含有原子数为3NA | |
| B. | 标准状况下,22.4 LSO3与水反应生成1mol硫酸 | |
| C. | 1L 1mol/L醋酸溶液中离子总数为2NA | |
| D. | 足量铜与18mol•L-11L浓硫酸反应可以得到SO2的分子总数为9NA |
8.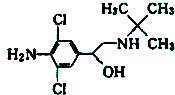 央视曝光了双汇在食品生产中使用“瘦肉精”,一时间,市场哗然.瘦肉精的结构简式如图,下列有关说法错误的是( )
央视曝光了双汇在食品生产中使用“瘦肉精”,一时间,市场哗然.瘦肉精的结构简式如图,下列有关说法错误的是( )
 央视曝光了双汇在食品生产中使用“瘦肉精”,一时间,市场哗然.瘦肉精的结构简式如图,下列有关说法错误的是( )
央视曝光了双汇在食品生产中使用“瘦肉精”,一时间,市场哗然.瘦肉精的结构简式如图,下列有关说法错误的是( )| A. | 该有机物的核磁共振氢谱图中有6个吸收峰 | |
| B. | 该有机物的分子式为C12H18N2Cl2O | |
| C. | 该有机物能溶于水,且水溶液显碱性 | |
| D. | 该有机物能发生加成反应、取代反应、氧化反应和酯化反应 |