题目内容
13.下表列出了A~F,6种元素在周期表中的位置:| 主族 周期 | IA | ⅡA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | D | F | |||||
| 3 | A | B | C | E |
(2)A、B、C三种元素的氧化物对应的水化物,其中碱性最强的是(填化学式)NaOH.
(3)D、E、F三种元素中非金属性最强的是F(填元素符号).
分析 (1)由元素在周期表的位置可知,A为Na,B为Mg,C为Al,D为C,E为S,F为F;
(2)金属性越强,对应碱的碱性越强;
(3)周期表中F的非金属性最强.
解答 解:(1)由元素在周期表的位置可知,A为Na,B为Mg,C为Al,D为C,E为S,F为F,故答案为:Na;Mg;Al;C;S;F;
(2)金属性Na>Mg>Al,三种元素的氧化物对应的水化物,其中碱性最强的是NaOH,故答案为:NaOH;
(3)同主族从上到下非金属性减弱,同周期从左向右非金属性增强,则D、E、F三种元素中非金属性最强的是F,故答案为:F.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
11.下列有关实验描述说法正确的是( )
| 选项 | 实验描述 |
| A | 将SO2通入到紫色石蕊溶液中,溶液先变红后褪色 |
| B | 将SO2通入到KMnO4(H+)溶液中,紫色褪去 |
| C | 将Cl2与SO2 按物质的量之比1:1混合后,通入到品红溶液中,红色褪去 |
| D | 将CO2通入BaCl2溶液,出现白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
12.下列说法正确的是( )
| A. | 酸性氧化物一定是非金属氧化物 | B. | 碱性氧化物一定是金属氧化物 | ||
| C. | 氧气和臭氧是氧元素的不同核素 | D. | H2 D2 T2 互为同位素 |
1.CoO是电子陶瓷所需的重要原料,工业上可用含有Co2O3、Fe2O3、Li和Al等物质的废料制备CoO.生产流程如图:

已知:①Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表:
(1)为提高碱溶速率,除适当增大NaOH溶液浓度、提高反应温度外,还可采取的措施有将废料研磨成更小颗粒.
(2)步骤Ⅱ中酸溶时发生了反应:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O,此反应的目的是溶解Co2O3,将三价钴转化为Co2+,便于沉淀除去Fe3+.
(3)步骤Ⅲ中加入Na2CO3溶液的作用是调节溶液的pH,物质X的化学式为Fe(OH)3.
(4)步骤Ⅲ中加入NaF对步骤Ⅳ所起的作用是降低溶液中Li+浓度,避免步骤Ⅵ中产生Li2CO3沉淀.
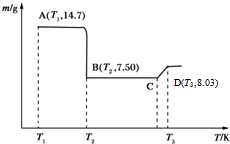
(5)操作A的步骤为过滤、洗涤、干燥,将所得的草酸钴晶体高温灼烧,其热重分析图如图:写出B点物质的化学式:CoO,CD段发生反应的化学方程式为:6CoO+O2=2Co3O4.

已知:①Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表:
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(2)步骤Ⅱ中酸溶时发生了反应:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O,此反应的目的是溶解Co2O3,将三价钴转化为Co2+,便于沉淀除去Fe3+.
(3)步骤Ⅲ中加入Na2CO3溶液的作用是调节溶液的pH,物质X的化学式为Fe(OH)3.
(4)步骤Ⅲ中加入NaF对步骤Ⅳ所起的作用是降低溶液中Li+浓度,避免步骤Ⅵ中产生Li2CO3沉淀.
(5)操作A的步骤为过滤、洗涤、干燥,将所得的草酸钴晶体高温灼烧,其热重分析图如图:写出B点物质的化学式:CoO,CD段发生反应的化学方程式为:6CoO+O2=2Co3O4.

8.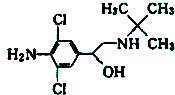 央视曝光了双汇在食品生产中使用“瘦肉精”,一时间,市场哗然.瘦肉精的结构简式如图,下列有关说法错误的是( )
央视曝光了双汇在食品生产中使用“瘦肉精”,一时间,市场哗然.瘦肉精的结构简式如图,下列有关说法错误的是( )
 央视曝光了双汇在食品生产中使用“瘦肉精”,一时间,市场哗然.瘦肉精的结构简式如图,下列有关说法错误的是( )
央视曝光了双汇在食品生产中使用“瘦肉精”,一时间,市场哗然.瘦肉精的结构简式如图,下列有关说法错误的是( )| A. | 该有机物的核磁共振氢谱图中有6个吸收峰 | |
| B. | 该有机物的分子式为C12H18N2Cl2O | |
| C. | 该有机物能溶于水,且水溶液显碱性 | |
| D. | 该有机物能发生加成反应、取代反应、氧化反应和酯化反应 |
18.下列变化属于化学变化的是( )
| A. | 活性炭使品红褪色 | B. | 用苯从碘水中提取碘 | ||
| C. | 常温下铁遇浓硫酸钝化 | D. | 干冰升华 |
5.参照反应Br+H2→HBr+H的能量对反应历程的示意图,下列叙述中正确的是( )


| A. | 正反应为吸热反应 | |
| B. | 加人催化剂,该化学反应的反应热改变 | |
| C. | 反应物总能量高于生成物总总量 | |
| D. | 升高温度可增大正反应速率,降低逆反应速率 |
2.如图所示原电池装置中,电解质溶液为稀盐酸,下列有关叙述错误的是( )


| A. | 锌做正极发生还原反应 | |
| B. | 供电时的总反应为:Zn+2H+=Zn2++H2 | |
| C. | 该装置可实现化学能转化为电能 | |
| D. | 产生1molH2,消耗锌的质量65g |