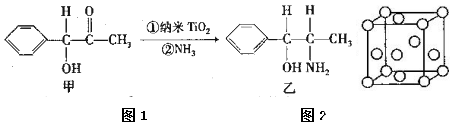
题目内容
2.①写出Na2SO4的电离方程式Na2SO4=2Na++SO42-.②氧化铝和氢氧化钠溶液反应的离子反应方程式Al2O3+2OH-=2AlO2-+H2O.
③OH-+H+═H2O改写为化学方程式H2SO4+2NaOH=2H2O+Na2SO4.
分析 ①硫酸钠是可溶性的强电解质,完全电离生成钠离子和硫酸根离子;
②Al 2 O3和NaOH溶液反应生成可溶性的偏铝酸钠和弱电解质水;
③该离子方程式表示强酸或强酸酸式盐和强碱反应生成可溶性的盐和水.
解答 解:①硫酸钠是可溶性的强电解质,完全电离生成钠离子和硫酸根离子,电离方程式为Na2SO4=2Na++SO42-,
故答案为:Na2SO4=2Na++SO42-;
②Al 2 O3和NaOH溶液反应生成可溶性的偏铝酸钠和弱电解质水,离子方程式为Al 2 O3+2OH-=2AlO2-+H2O,
故答案为:Al 2 O3+2OH-=2AlO2-+H2O;
③该离子方程式表示强酸或强酸酸式盐和强碱反应生成可溶性的盐和水,如H2SO4+2NaOH=2H2O+Na2SO4,
故答案为:H2SO4+2NaOH=2H2O+Na2SO4.
点评 本题考查离子方程式和电离方程式的书写,为高频考点,明确电解质的性质、离子方程式书写规则是解本题关键,离子方程式表示一类反应、化学方程式表示一种反应.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.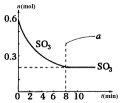 在一个2L的密闭容器中,发生反应:2SO3(g)?2SO2(g)+O2(g)-Q (Q>0),其中SO3的物质的量随时间变化如图所示,下列判断错误的是( )
在一个2L的密闭容器中,发生反应:2SO3(g)?2SO2(g)+O2(g)-Q (Q>0),其中SO3的物质的量随时间变化如图所示,下列判断错误的是( )
 在一个2L的密闭容器中,发生反应:2SO3(g)?2SO2(g)+O2(g)-Q (Q>0),其中SO3的物质的量随时间变化如图所示,下列判断错误的是( )
在一个2L的密闭容器中,发生反应:2SO3(g)?2SO2(g)+O2(g)-Q (Q>0),其中SO3的物质的量随时间变化如图所示,下列判断错误的是( )| A. | 0~8min内v(SO3)=0.025mol/(L•min) | |
| B. | 8min时,v逆(SO2)=2v正 (O2) | |
| C. | 8min时,容器内压强保持不变 | |
| D. | 若8min时将容器压缩为1L,n(SO3)的变化如图中a |
14.某有机物的结构简式为 ,其分子结构中处在同一平面内的原子最多有( )
,其分子结构中处在同一平面内的原子最多有( )
 ,其分子结构中处在同一平面内的原子最多有( )
,其分子结构中处在同一平面内的原子最多有( )| A. | 15个 | B. | 16个 | C. | 17个 | D. | 18个 |
17.在两个密闭容器中,分别充满等物质的量的甲、乙两种气体,它们的温度和摩尔质量均相同.试根据甲、乙的密度(ρ)的关系,下列说法中正确的是( )
| A. | 若ρ(甲)<ρ(乙),则气体的压强:甲>乙 | B. | 若ρ(甲)>ρ(乙),则分子数:甲>乙 | ||
| C. | 若ρ(甲)<ρ(乙),则气体摩尔体积:甲<乙 | D. | 若ρ(甲)>ρ(乙),则气体体积:甲<乙 |
7.设NA为阿伏加德罗常数值.下列有关叙述正确的是( )
| A. | 标准状况下,2.24 LCCl4含有的共价键数为0.4NA | |
| B. | 1 molN2与4 mol H2反应生成的NH3分子数为2NA | |
| C. | 1 molFe溶于过量硝酸,电子转移数为2NA | |
| D. | 34g H2O2和H2S混合物中的氢原子数为2NA |
14.下列有关实验室一般事故的预防和处理方法正确的是( )
| A. | 燃着的酒精灯打翻失火,立即用水浇灭 | |
| B. | 若不慎将浓碱液沾在皮肤上,立即用大量水冲洗,再涂上适量的稀硼酸溶液 | |
| C. | 用氢气还原氧化铜时,先加热再通入氢气,以免浪费氢气 | |
| D. | 配制稀硫酸时,可先在量筒中加入一定量的水,再在搅拌下缓慢加入浓硫酸 |