题目内容
16.锡及其化合物在生产、生活中有着重要的用途.已知:Sn的熔点为231℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33℃、沸点为114℃.请按要求回答下列相关问题:(1)元素锡比同主族碳的周期数大3,锡的原子序数为50.
(2)用于微电子器件生产的锡粉纯度测定:①取1.19 g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;②加入过量的Fe2(SO4)3;③用0.1000 mol/L K2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL.步骤②中加入Fe2(SO4)3的作用是将Sn2+全部氧化为Sn4+;此锡粉样品中锡的质量分数60%.
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:
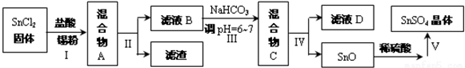
①步骤Ⅰ加入Sn粉的作用:防止Sn2+被氧化及调节溶液pH.
②步骤Ⅲ生成SnO的离子方程式:Sn2++2HCO3-=SnO↓+2CO2↑+H2O.
③步骤Ⅳ中检验SnO是否洗涤干净的操作是取最后一次滤液少许于试管中,依次滴加足量硝酸、少量硝酸银溶液,观察到无白色沉淀,证明已洗净.
④步骤Ⅴ操作依次为蒸发浓缩、冷却结晶、过滤、洗涤、低温干燥.
(4)SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为SnCl4+4NH3+4H2O=Sn(OH)4+4NH4Cl.
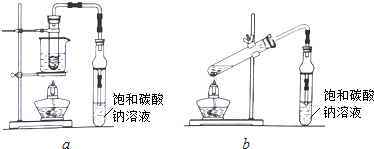
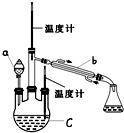
实验室欲用图装置制备少量SnCl4 (夹持装置略),该装置存在明显缺陷,改进方法是在A、B装置间依次连接盛有饱和食盐水、浓硫酸的洗气瓶;熔融锡与氯气化合的反应是放热反应,且放出的热足够此反应持续进行.
分析 (1)元素锡比同主族碳的周期数大3,二者原子序数相差第三、四、五周期容纳元素种数之和;
(2)Fe2(SO4)3将Sn2+全部氧化为Sn4+,再用溶液K2Cr2O7溶液滴定,将Fe2+氧化为Fe3+,根据电子转移守恒,整个过程关系式为:3Sn~3Sn2+~6Fe3+~6Fe2+~Cr2O72-,据此计算;
(3)由于Sn2+易水解、易被氧化,加入盐酸,抑制Sn2+水解,加入Sn粉可以与盐酸反应,调节溶液pH,还防止Sn2+被氧化,步骤Ⅱ为过滤,得SnCl2溶液,向其中加碳酸氢钠,调节溶液pH,使Mn元素以SnO形式沉淀,再过滤洗涤得纯净的SnO,加稀硫酸,得SnSO4溶液,加热浓缩、冷却结晶、过滤、洗涤,制得SnSO4晶体,滤液D中含有大量的NaCl等.
③得到沉淀是SnO,Sn元素化合价为变化,属于非氧化还原反应,变质发生水解反应生成Sn(OH)2与二氧化碳,Sn(OH)2再脱水得到SnO;
④沉淀为SnO表面附着着Cl-,要想检验滤渣是否洗涤干净,用硝酸、硝酸银溶液检验最后一次洗涤液中是否含有Cl-;
(4)SnCl4水解得到Sn(OH)4与HCl,HCl与氨气反应得到NH4Cl;
由于SnCl4易水解,制备中应在干燥环境中进行,制备的氯气中含有HCl、水蒸气,需要除去,防止Sn与HCl反应,SnCl4水解;
熔融锡与氯气化合的反应是放热反应,且放出的热足够此反应持续进行.
解答 解:(1)元素锡比同主族碳的周期数大3,二者原子序数相差第三、四、五周期容纳元素种数之和,则Sn的原子序数为6+8+18+18=50,
故答案为:50;
(2)Fe2(SO4)3将Sn2+全部氧化为Sn4+,再用溶液K2Cr2O7溶液滴定,将Fe2+氧化为Fe3+,
设粉中锡的质量分数为x,则:
3Sn~3Sn2+~6Fe3+~6Fe2+~K2Cr2O7
3×119g 1mol
1.19g×x 0.100mol/L×0.02L
故3×119g:1.19g×x=1mol:0.100mol/L×0.02L
解得x=60%,
故答案为:将Sn2+全部氧化为Sn4+;60%.
(3)由于Sn2+易水解、易被氧化,加入盐酸,抑制Sn2+水解,加入Sn粉可以与盐酸反应,调节溶液pH,还防止Sn2+被氧化,步骤Ⅱ为过滤,得SnCl2溶液,向其中加碳酸氢钠,调节溶液pH,使Mn元素以SnO形式沉淀,再过滤洗涤得纯净的SnO,加稀硫酸,得SnSO4溶液,加热浓缩、冷却结晶、过滤、洗涤,制得SnSO4晶体,滤液D中含有大量的NaCl等.
①由信息可知,Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;
故答案为:防止Sn2+被氧化;
②得到沉淀是SnO,Sn元素化合价为变化,属于非氧化还原反应,变质发生水解反应生成Sn(OH)2与二氧化碳,Sn(OH)2再脱水得到SnO,反应离子方程为:Sn2++2HCO3-=SnO↓+2CO2↑+H2O,
故答案为:Sn2++2HCO3-=SnO↓+2CO2↑+H2O
③沉淀为SnO表面附着着Cl-,要想检验滤渣是否洗涤干净,用硝酸、硝酸银溶液检验最后一次洗涤液中是否含有Cl-,具体方案为:取最后一次滤液少许于试管中,依次滴加足量硝酸、少量硝酸银溶液,观察到无白色沉淀,说明洗涤干净
故答案为:取最后一次滤液少许于试管中,依次滴加足量硝酸、少量硝酸银溶液,观察到无白色沉淀;
④由流程图可知,操作V是从溶液中得到含结晶水的晶体,只能采取蒸发浓缩、冷却结晶、过滤、洗涤得到,
故答案为:蒸发浓缩、冷却结晶;
(4)SnCl4水解得到Sn(OH)4与HCl,HCl与氨气反应得到NH4Cl,反应方程式为:SnCl4+4NH3+4H2O=Sn(OH)4+4NH4Cl;
由于SnCl4易水解,制备中应在干燥环境中进行,制备的氯气中含有HCl、水蒸气,需要除去,防止Sn与HCl反应,SnCl4水解,改进方法是:在A、B装置间依次连接盛有饱和食盐水、浓硫酸的洗气瓶;
熔融锡与氯气化合的反应是放热反应,且放出的热足够此反应持续进行,
故答案为:SnCl4+4NH3+4H2O=Sn(OH)4+4NH4Cl;在A、B装置间依次连接盛有饱和食盐水、浓硫酸的洗气瓶;熔融锡与氯气化合的反应是放热反应,且放出的热足够此反应持续进行.
点评 本题属于拼合型题目,涉及物质制备方案、化学工艺流程、物质含量测定、元素周期表与元素周期律等,是对学生综合能力的考查,需要学生具备扎实的基础与良好的心理素质,难度中等.

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案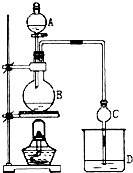 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知 ①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH;②有关有机物的沸点:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知 ①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH;②有关有机物的沸点:| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
(1)浓硫酸的作用是催化剂、吸水剂;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式CH3COOH+CH3CH218OH$?_{△}^{浓硫酸}$CH3CO18OC2H5+H2O.
(2)球形干燥管C的作用是防止倒吸、冷凝.若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-;反应结束后D中的现象是溶液分层、上层无色油体液体,下层溶液颜色变浅.
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分液(填操作名称)后,除去乙醇和水;然后对液体混合物进行蒸馏,收集77.1℃左右的馏分,以得到较纯净的乙酸乙酯.
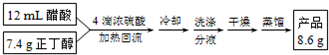
 某实验小组用如图所示装置(略去加热装置)制备 乙酸乙酯.
某实验小组用如图所示装置(略去加热装置)制备 乙酸乙酯.(1)仪器C的名称是三颈烧瓶,要向C中加4mL浓硫酸、6mL乙醇、4mL乙酸,
其操作顺序是乙醇、浓硫酸、乙酸.
(2)硫酸分子结构式:
 浓硫酸溶于乙醇不是简单的物理溶解,而是伴随着化学变化,生成硫酸乙酯和硫酸二乙酯,请写出乙醇和硫酸反应生成硫酸二乙酯的方程式2C2H5OH+H2SO4→(OC2H5)2SO2+2H2O.
浓硫酸溶于乙醇不是简单的物理溶解,而是伴随着化学变化,生成硫酸乙酯和硫酸二乙酯,请写出乙醇和硫酸反应生成硫酸二乙酯的方程式2C2H5OH+H2SO4→(OC2H5)2SO2+2H2O.(3)合成乙酸乙酯的反应为放热反应.实验研究表明,反应温度应控制在85℃左右为宜.请根据反应原理分析温度控制的原因:温度低,反应速率低,达不到催化剂活性温度,温度过高;温度过高,利于平衡逆向移动,酯产率降低.
(4)反应完成后,得到粗产品进行除杂.
①把锥形瓶中的粗产品转移到分液漏斗中,加适量的饱和Na2CO3溶液,充分振荡静置,分离时,乙酸乙酯应该从仪器上口倒出(填“下口放出”或“上口倒出”).查阅资料,
相关物质的部分性质:
| 乙醇 | 乙酸 | 乙酸乙酯 | |
| 沸点 | 78.0℃ | 117.9℃ | 77.5℃ |
| 水溶性 | 易溶 | 易溶 | 难溶 |
②为了得到纯度高的产品,一般在①中得到的乙酸乙酯用氯化钙除去其中少量的乙醇,最后用b(选填序号)进行干燥.
a、浓硫酸b、无水硫酸钠c、碱石灰.
| 密度/(g•cm-3) | 沸点/℃ | 水溶性 | |
| 1-丁醇 | 0.81 | 117.7 | 可溶 |
| 乙 酸 | 1.05 | 117.9 | 互溶 |
| 乙酸丁酯 | 0.88 | 126.3 | 微溶 |
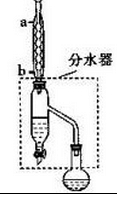
(1)装置a的名称是球形冷凝管,其中冷却水的流动方向是下口进上口出.
(2)制取乙酸丁酯的化学方程式为CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH2CH2CH3+H2O.加热回流时,分水器中液体分为两层,适时放出水使上层液体流入烧瓶b,从平衡角度考虑,分水器的作用是除去酯化反应生成的水,使生成乙酸丁酯的平衡向正反应方向移动.
(3)反应结束后,把分水器中的酯层和b中的反应液一起倒入分液漏斗中.在分液漏斗中加入10 mL水洗涤,除去下层,上层继续用10 mL 10% Na2CO3溶液洗涤至中性,分液后将上层液体再用10 mL水洗涤,除去溶于酯中的少量无机盐.下列说法不正确的是D(填序号).
A.最初用10 mL水洗涤的目的是除去酸及少量的正丁醇
B.用10 mL 10% Na2CO3洗涤的目的是除去残留的硫酸和乙酸
C.分液时先将水层从分液漏斗的下口放出,再将乙酸丁酯从上口到出
D.分液时先将水层从分液漏斗的下口放出,再将乙酸丁酯从下口放出
(4)在洗涤、分液后的乙酸丁酯中加入少量无水硫酸镁,其目的是除去乙酸丁酯中的水(或干燥乙酸丁酯).
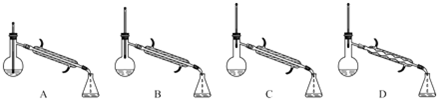
(5)在蒸馏操作中,仪器选择及安装都正确的是C(填标号).
(6)本实验的产率是74%.
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH ②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
(1)浓硫酸的作用:催化剂、吸水剂;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:CH3COOH+CH3CH218OH$?_{△}^{浓硫酸}$CH3CO18OC2H5+H2O.
(2)球形干燥管C的作用是防止倒吸、冷凝.若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-;反应结束后D中的现象是溶液分层,上层无色油体液体,下层溶液颜色变浅.
(3)该小组同学在实验时才取了加入过量的乙醇,目的是增加乙醇的用量提高乙酸的转化率和提高产率,同时慢慢滴加乙酸并加热蒸馏,蒸馏的目的是蒸馏出乙酸乙酯,减小生成物,反应正向移动,提高产率 .
(4)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出乙醇和水;再加入(此空从下列选项中选择)C;然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯.
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰.
| A. | 物质发生化学变化不一定伴随着能量变化 | |
| B. | 硫酸钡、醋酸铵、氨水都是弱电解质 | |
| C. | 向0.1 mol•L-1 Na2CO3溶液中滴加酚酞,溶液变红色 | |
| D. | 在温度、压强一定的条件下,自发反应总是向△H-T△S<0的方向进行 |