题目内容
纳米氧化亚铜(Cu2O)是一种用途广泛的光电材料,常用的制备方法有电化学法、湿化学法等.电化学法可用铜棒和石墨作电极,电解Cu(NO3)2稀溶液制备.湿化学法的制备过程为:在KOH溶液中加入一定量的CuSO4溶液,再加入一定量的还原剂--肼(N2H4),加热并保持温度在90℃.检验反应完全后,分离、洗涤、真空干燥得到固体样品.反应方程式为:4CuSO4+N2H4+8KOH═2Cu2O+N2↑+4K2SO4+6H2O
(1)电化学法制备Cu2O时,铜棒做 极,阴极生成Cu2O的电极反应式为 .
(2)湿化学法中,检验纳米Cu2O已经生成的实验方法是 .
(3)湿化学法得到的产品中常含有Cu.称取某产品1.76g(设仅含Cu2O和Cu),加入足量的稀硝酸,充分反应后得到标准状况下的NO气体224mL,试计算产品中Cu2O的质量分数 .
(1)电化学法制备Cu2O时,铜棒做
(2)湿化学法中,检验纳米Cu2O已经生成的实验方法是
(3)湿化学法得到的产品中常含有Cu.称取某产品1.76g(设仅含Cu2O和Cu),加入足量的稀硝酸,充分反应后得到标准状况下的NO气体224mL,试计算产品中Cu2O的质量分数
考点:制备实验方案的设计,化学方程式的有关计算,原电池和电解池的工作原理
专题:计算题,电化学专题
分析:(1)电化学法制备Cu2O时,阴极生成Cu2O,铜离子被还原,铜应为阳极,阳极生成铜离子,以补充铜离子;
(2)检验纳米Cu2O,在检验溶液是否具有丁达尔效应;
(3)设含铜的物质的量为xmol,氧化亚铜的物质的量为ymol,根据质量关系和电子守恒列式计算出铜的物质的量,再计算出铜的质量分数.
(2)检验纳米Cu2O,在检验溶液是否具有丁达尔效应;
(3)设含铜的物质的量为xmol,氧化亚铜的物质的量为ymol,根据质量关系和电子守恒列式计算出铜的物质的量,再计算出铜的质量分数.
解答:
解:(1)电化学法制备Cu2O时,阴极生成Cu2O,铜离子被还原,电极方程式为2Cu2++2e-+H2O═Cu2O+2H+,铜应为阳极,阳极生成铜离子,以补充铜离子,
故答案为:阳极;2Cu2++2e-+H2O═Cu2O+2H+;
(2)检验纳米Cu2O,在检验溶液是否具有丁达尔效应,故答案为:丁达尔效应;
(3)产生一氧化氮气体的物质的量为:0.01mol
设含铜的物质的量为xmol,氧化亚铜的物质的量为ymol,
64x+144y=1.76g,
2x+2y=0.01×3,
解得x=0.005mol,y=0.01mol,
w(Cu2O)=
=0.818.
故答案为:0.818.
故答案为:阳极;2Cu2++2e-+H2O═Cu2O+2H+;
(2)检验纳米Cu2O,在检验溶液是否具有丁达尔效应,故答案为:丁达尔效应;
(3)产生一氧化氮气体的物质的量为:0.01mol
设含铜的物质的量为xmol,氧化亚铜的物质的量为ymol,
64x+144y=1.76g,
2x+2y=0.01×3,
解得x=0.005mol,y=0.01mol,
w(Cu2O)=
| 0.01mol×144g/mol |
| 1.76g |
故答案为:0.818.
点评:本题考查较为综合,涉及氧化亚铜的制备,侧重于学生的分析能力和实验能力、计算能力的考查,为高频考点,注意把握电极方程式的书写,难度中等.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
已知:将一定量Cl2通入KOH溶液,可能生成KCl、KClO、KClO3,且
的值与温度高低有关.当n(KOH)=6a mol时,下列有关说法错误的是( )
| c(Cl-) |
| c(ClO-) |
A、若某温度下,反应后
| ||||||
| B、参加反应的氯气的物质的量等于3a mol | ||||||
| C、改变温度,反应中转移电子的物质的量ne的范围:3a mol<ne<5a mol | ||||||
| D、改变温度,产物中KClO3的最大理论产量为a mol |
核电荷数为1~18的两种元素X、Y,X元素原子的最外层电子数与次外层电子数差的绝对值等于电子层数,Y元素比X元素的原子多2个最外层电子.则X与Y不可能形成的化合物( )
| A、X2Y |
| B、XY2 |
| C、XY3 |
| D、XY |
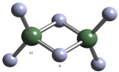 科技日报2007年1月30日讯:美、德科学家日前成功合成出具有独特化学特性的氢铝化合物(AlH3)n,其结构类似由硼和氢组成的硼烷,有关研究报告发表在最新出版的美国《科学》杂志上.最简单的氢铝化合物为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法肯定不正确的是( )
科技日报2007年1月30日讯:美、德科学家日前成功合成出具有独特化学特性的氢铝化合物(AlH3)n,其结构类似由硼和氢组成的硼烷,有关研究报告发表在最新出版的美国《科学》杂志上.最简单的氢铝化合物为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法肯定不正确的是( )| A、Al2H6中H为+1价,Al为-3价 |
| B、Al2H6在空气中完全燃烧,产物为氧化铝和水 |
| C、Al2H6分子是非极性分子 |
| D、氢铝化合物可能成为未来的储氢材料和火箭燃料 |
下列说法正确的是( )
| A、当7.8g Na2O2与H2O完全反应时,有0.2mol电子发生了转移 |
| B、将1.5molBr2通入2molFeI2溶液中的离子方程式3Br2+2I-+4Fe2+═2Br-+I2+2Fe3+ |
| C、用浓盐酸酸化KMnO4溶液以增强其氧化性 |
| D、在3NO2+H2O═2HNO3+NO中,氧化剂和还原剂的质量比为1:2 |
 )广泛存在于水果中,尤以苹果、葡萄、西瓜、山楂内为多.
)广泛存在于水果中,尤以苹果、葡萄、西瓜、山楂内为多.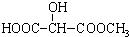 B.
B. C.H3COOC-COOCH3
C.H3COOC-COOCH3 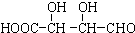 E.
E.