题目内容
已知X、Y、Z、L四种元素是人体内的主要元素且原子序数依次增大.回答下列问题:
(1)L的元素符号为 ;Y元素原子核外电子中,未成对电子数与成对电子数之比为 ;四种元素的原子半径从大到小的顺序是 (用元素符号表示).
(2)Z、X两元素按原子数目比1:3可构成分子A,A的电子式为 ;B分子也由Z、X两元素组成,作为运送飞船的火箭燃料,常温下是一种液态化合物.已知该化合物的相对分子质量为32,其中X元素的质量分数为12.5%,且该分子结构中只有单键.则B的结构式为 .若64gB分子与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,还放出3000kJ的热量,写出该反应的热化学方程式 .
(3)硒(Se)是人体必需的微量元素,与元素L同一主族,该族第2-5周期元素单质分别与H2反应生成1mol气态氢化物产生的热量数据如下,其中能表示生成1mol硒化氢所产生的热效应是 (选填字母编号).
a.吸热99.7kJ;b.吸热29.7kJ;c.放热20.6kJ;d.放热241.8kJ.
(1)L的元素符号为
(2)Z、X两元素按原子数目比1:3可构成分子A,A的电子式为
(3)硒(Se)是人体必需的微量元素,与元素L同一主族,该族第2-5周期元素单质分别与H2反应生成1mol气态氢化物产生的热量数据如下,其中能表示生成1mol硒化氢所产生的热效应是
a.吸热99.7kJ;b.吸热29.7kJ;c.放热20.6kJ;d.放热241.8kJ.
考点:原子结构与元素的性质,有关反应热的计算,热化学方程式
专题:化学反应中的能量变化,原子组成与结构专题
分析:X、Y、Z、L四种元素是人体内的主要元素且原子序数依次增大,
(1)人体中主要存在C、H、O、N元素,L原子序数最大,则L为O元素,X为H、Y为C、Z为N元素;
C元素原子核外电子中,未成对电子数与成对电子数之比为2:4=1:2;原子电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数最大而减小;
(2)N、H两元素按原子数目比1:3可构成分子A,A为NH3,氨气分子中N原子和每个H原子形成一个共用电子对,N原子还存在一个孤电子对;
B分子也由Z、X两元素组成,作为运送飞船的火箭燃料,常温下是一种液态化合物,该化合物的相对分子质量为32,其中X元素的质量分数为12.5%,则B为N2H4,且该分子结构中只有单键,则B中每个N原子连接2个N原子且N原子之间存在一个共价键,据此书写B的结构式;
64gB的物质的量是2mol,2mol肼和双氧水完全反应生成氮气和水放出3000kJ的热量,则1mol肼和双氧水反应生成氮气和水放出1500kJ燃料,据此书写该反应的热化学方程式;
(3)Se和氢气反应需要不断加热才能反应,所以该反应是吸热反应,元素的非金属性越弱,其吸收的热量越大.
(1)人体中主要存在C、H、O、N元素,L原子序数最大,则L为O元素,X为H、Y为C、Z为N元素;
C元素原子核外电子中,未成对电子数与成对电子数之比为2:4=1:2;原子电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数最大而减小;
(2)N、H两元素按原子数目比1:3可构成分子A,A为NH3,氨气分子中N原子和每个H原子形成一个共用电子对,N原子还存在一个孤电子对;
B分子也由Z、X两元素组成,作为运送飞船的火箭燃料,常温下是一种液态化合物,该化合物的相对分子质量为32,其中X元素的质量分数为12.5%,则B为N2H4,且该分子结构中只有单键,则B中每个N原子连接2个N原子且N原子之间存在一个共价键,据此书写B的结构式;
64gB的物质的量是2mol,2mol肼和双氧水完全反应生成氮气和水放出3000kJ的热量,则1mol肼和双氧水反应生成氮气和水放出1500kJ燃料,据此书写该反应的热化学方程式;
(3)Se和氢气反应需要不断加热才能反应,所以该反应是吸热反应,元素的非金属性越弱,其吸收的热量越大.
解答:
解:(1)人体中主要存在C、H、O、N元素,L原子序数最大,则L为O元素,X为H、Y为C、Z为N元素;
C元素原子核外电子中,未成对电子数与成对电子数之比为2:4=1:2;原子电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数最大而减小,所以原子半径大小顺序是C>N>O>H,
故答案为:O;1:2; C>N>O>H;
(2)N、H两元素按原子数目比1:3可构成分子A,A为NH3,氨气分子中N原子和每个H原子形成一个共用电子对,N原子还存在一个孤电子对,其电子式为 ;
;
B分子也由Z、X两元素组成,作为运送飞船的火箭燃料,常温下是一种液态化合物,该化合物的相对分子质量为32,其中X元素的质量分数为12.5%,则B为N2H4,且该分子结构中只有单键,则B中每个N原子连接2个N原子且N原子之间存在一个共价键,B的结构式为 ,64gB的物质的量是2mol,2mol肼和双氧水完全反应生成氮气和水放出3000kJ的热量,则1mol肼和双氧水反应生成氮气和水放出1500kJ燃料,该反应的热化学方程式N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-1500 kJ/mol;
,64gB的物质的量是2mol,2mol肼和双氧水完全反应生成氮气和水放出3000kJ的热量,则1mol肼和双氧水反应生成氮气和水放出1500kJ燃料,该反应的热化学方程式N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-1500 kJ/mol;
故答案为: ;
; ;N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-1500 kJ/mol;
;N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-1500 kJ/mol;
(3)Se和氢气反应需要不断加热才能反应,所以该反应是吸热反应,元素的非金属性越弱,其吸收的热量越大,非金属性O>S>Se>Te,所以生成硒化氢需要吸收29.7kJ热量,故选b.
C元素原子核外电子中,未成对电子数与成对电子数之比为2:4=1:2;原子电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数最大而减小,所以原子半径大小顺序是C>N>O>H,
故答案为:O;1:2; C>N>O>H;
(2)N、H两元素按原子数目比1:3可构成分子A,A为NH3,氨气分子中N原子和每个H原子形成一个共用电子对,N原子还存在一个孤电子对,其电子式为
 ;
;B分子也由Z、X两元素组成,作为运送飞船的火箭燃料,常温下是一种液态化合物,该化合物的相对分子质量为32,其中X元素的质量分数为12.5%,则B为N2H4,且该分子结构中只有单键,则B中每个N原子连接2个N原子且N原子之间存在一个共价键,B的结构式为
 ,64gB的物质的量是2mol,2mol肼和双氧水完全反应生成氮气和水放出3000kJ的热量,则1mol肼和双氧水反应生成氮气和水放出1500kJ燃料,该反应的热化学方程式N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-1500 kJ/mol;
,64gB的物质的量是2mol,2mol肼和双氧水完全反应生成氮气和水放出3000kJ的热量,则1mol肼和双氧水反应生成氮气和水放出1500kJ燃料,该反应的热化学方程式N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-1500 kJ/mol;故答案为:
 ;
; ;N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-1500 kJ/mol;
;N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-1500 kJ/mol;(3)Se和氢气反应需要不断加热才能反应,所以该反应是吸热反应,元素的非金属性越弱,其吸收的热量越大,非金属性O>S>Se>Te,所以生成硒化氢需要吸收29.7kJ热量,故选b.
点评:本题考查热化学反应、原子结构和元素周期律等知识点,熟练掌握同一主族元素性质递变规律、原子结构等知识点即可解答,题目难度不大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
下列关于有机物的说法不正确的是( )
| A、鸡蛋清溶液中加入饱和Na2SO4溶液,有沉淀产生,再加入大量水,沉淀不溶解 |
| B、乙醇溶液常用于医疗消毒是因为它能使细菌蛋白体发生变性 |
| C、在临床上解救误服重金属盐中毒的病人时,常要求病人服用大量牛奶或豆浆 |
| D、皮肤、指甲不慎沾上浓硝酸会出现黄色 |
下列各组物质在适宜的条件下反应,其中氧化剂与还原剂物质的量之比为1:1的是( )
| A、F2+H2O |
| B、Li+O2(条件点燃) |
| C、CO2+Mg |
| D、NO2+H2O |
现有下列物质:①纤维素、②甲酸甲酯(HCOOCH3)、③淀粉、④甲醛(CH2O)、⑤丙酸、⑥乙酸,其中符合Cn(H2O)m的组成且不属于糖类的是( )
| A、①②④ | B、②④⑥ |
| C、①⑤⑥ | D、①③⑤ |

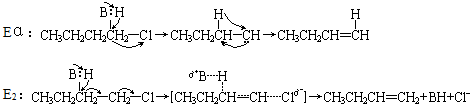
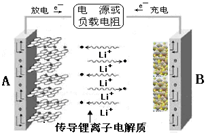 锂离子电池是具有电压高、能量密度大、循环性能好等突出优点的高效绿色产品.某锂离子电池的结构如右图所示,以石墨化的碳、氧化钴锂(LiCoO2)为电极,当充电时,阳极上发生的电极反应为LiCoO2-xe-=Li1-xCoO2+xLi+,总反应式为LiCoO2+6C=Li1-xCoO2+LixC6.
锂离子电池是具有电压高、能量密度大、循环性能好等突出优点的高效绿色产品.某锂离子电池的结构如右图所示,以石墨化的碳、氧化钴锂(LiCoO2)为电极,当充电时,阳极上发生的电极反应为LiCoO2-xe-=Li1-xCoO2+xLi+,总反应式为LiCoO2+6C=Li1-xCoO2+LixC6.