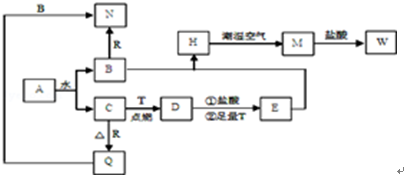
题目内容
下列化学反应中属于氮的固定的是( )
A、N2+O2
| ||||
| B、O2+2NO=2NO2 | ||||
| C、H2O+3NO2═NO+2HNO3 | ||||
D、4NH3+5O2
|
考点:氮的固定
专题:
分析:氮的固定指的是游离态的氮转化为化合态的氮.
解答:
解:A.N2与O2合成NO,氮由游离态转化为化合态,故A正确;
B.NO2、NO中的氮都是化合态,故B错误;
C.NO2、HNO3中的氮都是化合态,故C错误;
D.NH3、NO中的氮都是化合态,故D错误;
故选A.
B.NO2、NO中的氮都是化合态,故B错误;
C.NO2、HNO3中的氮都是化合态,故C错误;
D.NH3、NO中的氮都是化合态,故D错误;
故选A.
点评:本题考查了“氮的固定”的概念,判断时注意分析物质中N的化合价.

练习册系列答案
相关题目
海水中蕴含80多种元素,是一个巨大的宝藏,下列有关说法不正确的是( )
| A、锂元素在海水中含量很少,属于微量元素 |
| B、镁用于制造飞机、汽车、火箭,有“国防金属”的美誉 |
| C、从海水中提取物质不一定必须通过化学变化才能实现 |
| D、Mg在CO2中燃烧的反应,CO2既是氧化剂又是还原剂 |
根据下列反应判断有关物质的还原性由强到弱的顺序正确的是( )
①H2SO3+I2+H2O═2HI+H2SO4
②2FeCl3+2HI═2FeCl2+2HCl+I2
③3FeCl2+4HNO3═2FeCl3+NO↑+2H2O+Fe(NO3)3.
①H2SO3+I2+H2O═2HI+H2SO4
②2FeCl3+2HI═2FeCl2+2HCl+I2
③3FeCl2+4HNO3═2FeCl3+NO↑+2H2O+Fe(NO3)3.
| A、H2SO3>I->Fe2+>NO |
| B、I->H2SO3>Fe2+>NO |
| C、Fe2+>I->H2SO3>NO |
| D、NO>Fe2+>H2SO3>I- |
下列化学用语正确的是( )
A、CO2分子的比例模型: |
B、NH4Br的电子式: |
C、基态Fe原子的原子结构示意图: |
D、基态Al原子的价电子排布图: |
下列离子方程式正确的是( )
| A、铜溶于稀硝酸:Cu+2H++NO3-=Cu2++NO2↑+H2O | ||
| B、用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O=3I2+6OH- | ||
| C、向NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- | ||
D、向新制Cu(OH)2悬浊液中加入乙醛溶液并加热:CH3CHO+2Cu(OH)2+OH-
|
下列说法正确的是( )
| A、铅蓄电池在放电过程中,负极质量减小,正极质量增加 |
| B、设想把“H2+Cl2═2HCl”设计成燃料电池,用于工业制盐酸,并进行发电 |
| C、纯锌与稀硫酸反应产生氢气的速率较慢,再加入少量CuSO4固体,速率不变 |
| D、原电池的两极一定是由活泼性不同的两种金属组成 |
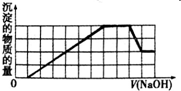 某溶液中可能含有H+、NH4+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示.下列说法正确的是( )
某溶液中可能含有H+、NH4+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示.下列说法正确的是( )| A、原溶液中含有的阳离子只有H+、Fe3+、Al3+ |
| B、原溶液中一定含有SO42-和Na+ |
| C、原溶液中含有的Fe3+和Al3+的物质的量之比为l:l |
| D、反应最后形成的溶液中溶质只有Na2SO4 |