题目内容
已知下列反应的热化学方程式为:
(1)C(s)+O2(g)═CO2(g)△H1=-393.5kJ/mol
(2)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H2=-870.3kJ/mol
(3)2H2(g)+O2(g)═2H2O(l)△H3=-571.6kJ/mol
请计算:2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H4= .
(1)C(s)+O2(g)═CO2(g)△H1=-393.5kJ/mol
(2)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H2=-870.3kJ/mol
(3)2H2(g)+O2(g)═2H2O(l)△H3=-571.6kJ/mol
请计算:2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H4=
考点:用盖斯定律进行有关反应热的计算
专题:化学反应中的能量变化
分析:依据热化学方程式,结合盖斯定律构造目标热化学方程式计算得到;
解答:
解:(1)C(s)+O2(g)═CO2(g)△H1=-393.5kJ/mol
(2)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H2=-870.3kJ/mol
(3)2H2(g)+O2(g)═2H2O(l)△H3=-571.6kJ/mol
依据盖斯定律计算(1)×2-(2)+(3)得到反应的热化学方程式:2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H4=-488.3KJ/mol;
故答案为:-488.3KJ/mol;
(2)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H2=-870.3kJ/mol
(3)2H2(g)+O2(g)═2H2O(l)△H3=-571.6kJ/mol
依据盖斯定律计算(1)×2-(2)+(3)得到反应的热化学方程式:2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H4=-488.3KJ/mol;
故答案为:-488.3KJ/mol;
点评:本题考查了热化学方程式和盖斯定律的计算应用,掌握基础是关键,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法正确的是( )
| A、在化合物SiC中,Si显正价、C显负价是因为C的电负性大于Si的电负性 |
| B、由于H与F的电负性差值为1.9大于1.7,所以HF是离子化合物 |
| C、基态C原子有两个未成对电子,所以最多只能形成2个共价键 |
| D、所有的原子轨道都具有一定的伸展方向,因此所有的共价键都具有方向性 |
有一无色溶液,仅含有K+、Al3+、Mg2+、NH
、Cl-、SO
、HCO
、MnO
中的几种.为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀全部溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,无沉淀产生.下列推断正确的是( )
+ 4 |
2- 4 |
- 3 |
- 4 |
A、肯定有Al3+、Mg2+、Cl-,可能有NH
| ||||||||
B、肯定有Al3+、K+、Cl-,肯定没有MnO
| ||||||||
C、肯定有Al3+、Cl-,一定没有HCO
| ||||||||
| D、该溶液可能显弱酸性,也可能显中性 |
基态铬原子的电子排布式是( )
| A、1S22S22p63S23p64S14p5 |
| B、1S22S22p63S23p63d6 |
| C、1S22S22p63S23p64S23d4 |
| D、1S22S22p63S23P63d54S1 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、64gSO2中含有的氧原子数为2NA |
| B、同温同压下,相同体积的任何气体所含原子个数相同 |
| C、40gNaOH溶解在1L水中,所制得的溶液,物质的量浓度为1mol?L-1 |
| D、标准状况下,11.2LH2O含有的电子数为5NA |
NaNO2是一种食品添加剂,它能致癌,酸性KMnO4溶液与NaNO2反应的离子方程式为MnO4-+NO2-+H+-Mn2++□+H2O (未配平).下列叙述正确的是( )
| A、反应后溶液pH下降 |
| B、通常用盐酸酸化的高锰酸钾溶液 |
| C、方框中粒子为NO2 |
| D、当生成1 mol Mn2+ 需消耗2.5 mol NO2- |
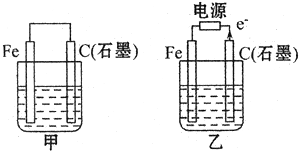 (1)若甲、乙两烧杯中均盛有饱和NaCI溶液.
(1)若甲、乙两烧杯中均盛有饱和NaCI溶液.