题目内容
在0.1mol/L的KHSO3溶液中,呈酸性,下列关系式正确的是( )
| A、c(SO32-)>c(HSO3-) |
| B、c(K+)=c(HSO3-)>c(OH-)>c(H+) |
| C、c(K+)+c(H+)=c(HSO3-)+c(OH-)+c(SO32-) |
| D、c(K+)=c(HSO3-)+c(SO32-)+c(H2SO3) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:已知KHSO3溶液呈弱酸性,说明HSO3--电离程度大于水解程度,
A.从溶液电中性,存在电荷守恒原则的角度分析;
B.从的电离、水解结合物料守恒分析;
C.比较电离程度和水解程度分析;
D.从物料守恒的角度分析.
A.从溶液电中性,存在电荷守恒原则的角度分析;
B.从的电离、水解结合物料守恒分析;
C.比较电离程度和水解程度分析;
D.从物料守恒的角度分析.
解答:
解:A.亚硫酸氢钾溶液呈酸性,说明HSO3-电离程度大于水解程度,则c(SO32-)<c(HSO3-),故A错误;
B.亚硫酸氢钾溶液中存在H2SO3、SO32-、HSO3-,c(K+)>c(HSO3-)>c(H+)>c(OH-),故B错误;
C.溶液遵循电中性原则,则有c(K+)+c(H+)=c(HSO3-)+c(OH-)+2c(SO32-),故C错误;
D.溶液遵循电中性原则,应有n(K)=n(S),则有c(K+)=c(H2SO3)+c(HSO3-)+c(SO32-),故D正确;
故选D.
B.亚硫酸氢钾溶液中存在H2SO3、SO32-、HSO3-,c(K+)>c(HSO3-)>c(H+)>c(OH-),故B错误;
C.溶液遵循电中性原则,则有c(K+)+c(H+)=c(HSO3-)+c(OH-)+2c(SO32-),故C错误;
D.溶液遵循电中性原则,应有n(K)=n(S),则有c(K+)=c(H2SO3)+c(HSO3-)+c(SO32-),故D正确;
故选D.
点评:本题考查离子浓度大小比较,题目难度中等,注意解答本题的关键是把握题中亚硫酸氢钾溶液呈酸性的特点,答题时注意溶液电中性以及物料守恒的运用.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
在体积恒定的密闭容器中,充入3molA和1molB发生反应:3A(g)+B(g)?xC(g),达平衡后,C在平衡混合气中的体积分数为w.若维持稳定不变,按1.2molA、0.4molB、0.6molC为起始物质,达平衡后压强不变,C的体积分数仍为w,则x的值为( )
| A、1 | B、2 | C、4 | D、1或4 |
0.1mol/L CH3COONa稀溶液中,下列离子浓度关系不正确的是( )
| A、c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| B、c(Na+)>c(CH3COO-)>c (OH-)>c(H+) |
| C、c(CH3COO- )+c(CH3COOH)=0.1 mol/L |
| D、c(Na+)>c(CH3COO-)>c (H+)>c(OH-) |
如图是某有机物分子的比例模型,有关该物质的推断不正确的是( )
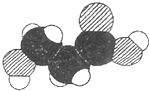

| A、分子中可能含有羟基 |
| B、分子中可能含有羧基 |
| C、该物质的分子式可能为C3H6O3 |
| D、分子中可能含有氨基 |
下列化学用语使用正确的组合是( )
A、乙炔的分子结构模型示意图: |
| B、二硫化碳的结构式:S═C═S |
C、NH4Cl的电子式: |
D、2-甲基丁醇的结构简式: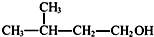 |
有甲、乙两瓶酸溶液,已知甲瓶溶液的pH=4,乙瓶溶液的pH=6,现将甲瓶溶液取出少量用蒸馏水稀释至100倍体积(温度不变),则下列叙述中正确的是( )
| A、稀释后两溶液的pH相等 |
| B、稀释后甲瓶溶液的pH一定小于乙溶液 |
| C、稀释后甲瓶溶液的pH小于或等于乙溶液 |
| D、稀释后甲瓶溶液的pH一定大于乙溶液 |
