题目内容
有甲、乙两瓶酸溶液,已知甲瓶溶液的pH=4,乙瓶溶液的pH=6,现将甲瓶溶液取出少量用蒸馏水稀释至100倍体积(温度不变),则下列叙述中正确的是( )
| A、稀释后两溶液的pH相等 |
| B、稀释后甲瓶溶液的pH一定小于乙溶液 |
| C、稀释后甲瓶溶液的pH小于或等于乙溶液 |
| D、稀释后甲瓶溶液的pH一定大于乙溶液 |
考点:pH的简单计算,弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:根据酸溶液的稀释定律:若pH=a的强酸,加水稀释至原来体积的10b倍,则pH=a+b(a+b<7,若a+b>7,则稀释后的pH=7);
若pH=a的弱酸酸,加水稀释至原来体积的10b倍,由于加水稀释时弱酸的电离平衡被促进,则稀释后pH<a+b,据此分析.
若pH=a的弱酸酸,加水稀释至原来体积的10b倍,由于加水稀释时弱酸的电离平衡被促进,则稀释后pH<a+b,据此分析.
解答:
解:甲、乙两瓶酸溶液,甲瓶溶液的pH=4,乙瓶溶液的pH=6,现将甲瓶溶液取出少量用蒸馏水稀释至100倍体积,
则若甲为强酸,则稀释后pH=6;
若甲为弱酸,由于稀释时电离平衡被促进,则稀释后pH<6,故稀释后甲瓶溶液的pH小于或等于乙溶液,故选C.
则若甲为强酸,则稀释后pH=6;
若甲为弱酸,由于稀释时电离平衡被促进,则稀释后pH<6,故稀释后甲瓶溶液的pH小于或等于乙溶液,故选C.
点评:本题考查了酸的稀释定律,要注意强酸和弱酸稀释相同倍数时溶液pH的变化的不同特点,所以本题要将甲分情况讨论,难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
下列物质的分离方法,不正确的是( )
| A、用过滤法分离氧化铜和硫酸铜的混合物 |
| B、用蒸馏的方法将自来水制成蒸馏水 |
| C、用酒精萃取溴水中的溴单质 |
| D、用结晶法分离氯化钠和硝酸钾的混合物 |
在0.1mol/L的KHSO3溶液中,呈酸性,下列关系式正确的是( )
| A、c(SO32-)>c(HSO3-) |
| B、c(K+)=c(HSO3-)>c(OH-)>c(H+) |
| C、c(K+)+c(H+)=c(HSO3-)+c(OH-)+c(SO32-) |
| D、c(K+)=c(HSO3-)+c(SO32-)+c(H2SO3) |
化学用语是学习化学的重要工具.下列化学用语正确的是( )
| A、钢铁腐蚀时可能发生的正极反应:4OH--4e-→2H2O+O2↑ |
| B、明矾水解反应的离子方程式:Al3++3H2O→Al(OH)3+3H+ |
C、乙烯的结构式: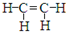 |
D、苯分子的球棍模型: |
下列化学用语使用正确的是( )
①CH4分子的球棍模型:
②次氯酸的电子式
③CO2分子的结构式:O═C═O
④聚氯乙烯的单体结构简式为CH2═CHCl
⑤葡萄糖的最简式(实验式):CH2O.
①CH4分子的球棍模型:

②次氯酸的电子式

③CO2分子的结构式:O═C═O
④聚氯乙烯的单体结构简式为CH2═CHCl
⑤葡萄糖的最简式(实验式):CH2O.
| A、①④⑤ | B、②③④ |
| C、②④⑤ | D、③④⑤ |
鉴别苯酚溶液,己烷,己烯,乙酸溶液和乙醇5种无色液体,可选用是最佳试剂是( )
| A、酸性KMnO4溶液、新制的Cu(OH)2悬浊液 |
| B、FeCl3溶液、金属钠、溴水、石蕊试液 |
| C、石蕊试液、溴水 |
| D、酸性KMnO4溶液、石蕊试液 |