题目内容
在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A、某溶液中:Ca2+、H+、Cl-、HSO3- |
| B、能使PH试纸呈红色的溶液:Na+、NH4+、Fe2+、NO3- |
| C、Na2CO3溶液:K+、Fe3+、SO42-、NO3- |
| D、Kw/c(H+)=0.1mol/L的溶液:Na+、K+、S2-、NO3- |
考点:离子共存问题
专题:离子反应专题
分析:A.H+、HSO3-反应生成气体和水;
B.使PH试纸呈红色的溶液呈酸性;
C.Na2CO3溶液呈碱性,Fe3+水解呈酸性;
D.c(OH-)=
=0.1mol/L,溶液呈碱性.
B.使PH试纸呈红色的溶液呈酸性;
C.Na2CO3溶液呈碱性,Fe3+水解呈酸性;
D.c(OH-)=
| Kw |
| c(H+) |
解答:
解:A.H+、HSO3-反应生成气体和水,二者不能大量共存,故A错误;
B.使PH试纸呈红色的溶液呈酸性,Fe2+、NO3-发生氧化还原反应,不能大量共存,故B错误;
C.CO32-与Fe3+发生互促水解而不能大量共存,故C错误;
D.c(OH-)=
=0.1mol/L,溶液呈碱性,碱性条件下,离子之间不发生任何反应,可大量共存,故D正确.
故选D.
B.使PH试纸呈红色的溶液呈酸性,Fe2+、NO3-发生氧化还原反应,不能大量共存,故B错误;
C.CO32-与Fe3+发生互促水解而不能大量共存,故C错误;
D.c(OH-)=
| Kw |
| c(H+) |
故选D.
点评:本题考查离子共存,为高考常见题型,题目多角度考查元素化合物知识,有利于培养学生良好的科学素养,注意把握离子的性质以及反应类型的判断,难度不大.

练习册系列答案
相关题目
一氧化碳还原氧化铜:CO+CuO
Cu+CO2,在该反应中( )
| ||
| A、CuO作还原剂 |
| B、CO作氧化剂 |
| C、铜元素的化合价降低 |
| D、碳元素的化合价降低 |
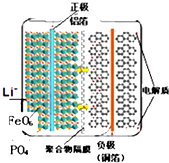 磷酸铁锂电池的内部结构如图所示,左边是磷酸铁锂电池材料为电池的正极,有铝箔与电池正极连接,中间是聚合物的隔膜,它把 正极与负极隔开,但锂离子Li+可以通过而电子电子不能通过,右边是由碳(石墨)组成的电池负极,由铜箔与电池的负极连接.电池的上下端之间是电池的电解质,电池由金属外壳密闭封装.电池的总反应为:Li1-xFePO4+LixC6
磷酸铁锂电池的内部结构如图所示,左边是磷酸铁锂电池材料为电池的正极,有铝箔与电池正极连接,中间是聚合物的隔膜,它把 正极与负极隔开,但锂离子Li+可以通过而电子电子不能通过,右边是由碳(石墨)组成的电池负极,由铜箔与电池的负极连接.电池的上下端之间是电池的电解质,电池由金属外壳密闭封装.电池的总反应为:Li1-xFePO4+LixC6| 放电 |
| 充电 |
| A、磷酸铁锂电池放电时,锂离子从负极中脱出来,经过电解液,穿过隔膜回到正极材料中 |
| B、放电时负极反应:C6Li-xe-═6C+xLi+ |
| C、充电时阳极反应:LiFePO4-xe-═Li1-xFePO4+xLi+ |
| D、若用该电池电解精炼粗铜,阳极质量减少12.8g时,则电池中通过聚合物隔膜的Li+数目为0.4NA |
下列关于浓H2SO4的叙述中,错误的是( )
| A、常温下可使某些金属钝化 |
| B、具有脱水性,故能作干燥剂 |
| C、加热条件下可与木炭反应,其氧化产物为CO2 |
| D、溶于水放出大量的热,稀释的时候应将浓硫酸缓缓加入水中并不断搅拌 |
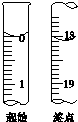 Na2SO3因易被氧化成Na2SO4而变质,某化学兴趣小组为了测定实验室存放的Na2SO3的纯度(假设不含其它杂质),进行如下实验.
Na2SO3因易被氧化成Na2SO4而变质,某化学兴趣小组为了测定实验室存放的Na2SO3的纯度(假设不含其它杂质),进行如下实验.
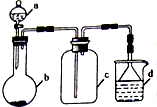 硫酸、盐酸和硝酸并称为工业上的“三大酸”,实验室中也常用三大酸制取某些气体,制取、收集及尾气处理装置如图所示(省略加热装置、夹持和净化装置).仅用此装置和表中提供的部分物质完成相关实验.
硫酸、盐酸和硝酸并称为工业上的“三大酸”,实验室中也常用三大酸制取某些气体,制取、收集及尾气处理装置如图所示(省略加热装置、夹持和净化装置).仅用此装置和表中提供的部分物质完成相关实验.