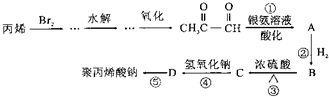
题目内容
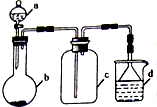 硫酸、盐酸和硝酸并称为工业上的“三大酸”,实验室中也常用三大酸制取某些气体,制取、收集及尾气处理装置如图所示(省略加热装置、夹持和净化装置).仅用此装置和表中提供的部分物质完成相关实验.
硫酸、盐酸和硝酸并称为工业上的“三大酸”,实验室中也常用三大酸制取某些气体,制取、收集及尾气处理装置如图所示(省略加热装置、夹持和净化装置).仅用此装置和表中提供的部分物质完成相关实验.| 序号 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
| 甲 | 浓硫酸 | Na2SO3 | ① | ② |
| 乙 | 浓硝酸 | Cu | ③ | NaOH |
| 丙 | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
(1)表格中①②③三种物质分别是
(2)实验乙中生成气体③的离子反应方程式为
(3)已知实验丙中生成氯气的化学方程式为4HCl(浓)+MnO2
| ||
考点:常见气体制备原理及装置选择,尾气处理装置
专题:
分析:(1)浓硫酸与Na2SO3反应生成二氧化硫,Cu与浓硝酸反应生成二氧化氮,处理尾气时酸性气体要用碱液吸收;
(2)Cu与浓硝酸反应生成硝酸铜、二氧化氮和水;NO不能用排空气法收集;
(3)根据氯原子守恒计算被氧化HCl的物质的量,根据氯气和转移电子之间的关系式计算转移电子的物质的量;氯气与氢氧化钠反应生成氯化钠和次氯酸钠、水;反应中KMnO4→MnCl2,Mn元素化合价由+7降低为+2,共降低5价,Cl(浓)→Cl2,Cl元素化合价由-1价升高为0价,共升高为2价,化合价升降最小公倍数为10,故KMnO4的系数为2,Cl2的系数为5,再根据原子守恒配平其它物质的系数.
(2)Cu与浓硝酸反应生成硝酸铜、二氧化氮和水;NO不能用排空气法收集;
(3)根据氯原子守恒计算被氧化HCl的物质的量,根据氯气和转移电子之间的关系式计算转移电子的物质的量;氯气与氢氧化钠反应生成氯化钠和次氯酸钠、水;反应中KMnO4→MnCl2,Mn元素化合价由+7降低为+2,共降低5价,Cl(浓)→Cl2,Cl元素化合价由-1价升高为0价,共升高为2价,化合价升降最小公倍数为10,故KMnO4的系数为2,Cl2的系数为5,再根据原子守恒配平其它物质的系数.
解答:
解:(1)浓硫酸与Na2SO3反应生成二氧化硫,Cu与浓硝酸反应生成二氧化氮,处理尾气时酸性气体要用NaOH溶液吸收;
故答案为:SO2;NO2;NaOH;
(2)Cu与浓硝酸反应生成硝酸铜、二氧化氮和水,则反应的离子方程式为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O;稀硝酸与Cu反应生成NO,NO能与空气中的氧气反应生成二氧化氮,所以NO不能用排空气法收集,所以不能用该装置制备NO;
故答案为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O;不正确;
(3)根据氯原子守恒得氧化n(HCl)=2n(Cl2)=
=2mol,Cl元素从-1价升高到0价,则1molHCl转移1mol电子,所以共转移2mol电子;
d装置为尾气处理装置,氯气与氢氧化钠反应生成氯化钠和次氯酸钠、水,其反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O;
反应中KMnO4→MnCl2,Mn元素化合价由+7降低为+2,共降低5价,Cl(浓)→Cl2,Cl元素化合价由-1价升高为0价,共升高为2价,化合价升降最小公倍数为10,故KMnO4的系数为2,Cl2的系数为5,再根据原子守恒配平其它物质的系数,配平后的方程式为2MnO4-+16H++10Cl-═2Mn2++5Cl2↑+8H2O;
故答案为:2mol;2mol;Cl2+2OH-=Cl-+ClO-+H2O;2、16、10、2、5、8H2O.
故答案为:SO2;NO2;NaOH;
(2)Cu与浓硝酸反应生成硝酸铜、二氧化氮和水,则反应的离子方程式为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O;稀硝酸与Cu反应生成NO,NO能与空气中的氧气反应生成二氧化氮,所以NO不能用排空气法收集,所以不能用该装置制备NO;
故答案为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O;不正确;
(3)根据氯原子守恒得氧化n(HCl)=2n(Cl2)=
| 22.4L |
| 22.4L/mol |
d装置为尾气处理装置,氯气与氢氧化钠反应生成氯化钠和次氯酸钠、水,其反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O;
反应中KMnO4→MnCl2,Mn元素化合价由+7降低为+2,共降低5价,Cl(浓)→Cl2,Cl元素化合价由-1价升高为0价,共升高为2价,化合价升降最小公倍数为10,故KMnO4的系数为2,Cl2的系数为5,再根据原子守恒配平其它物质的系数,配平后的方程式为2MnO4-+16H++10Cl-═2Mn2++5Cl2↑+8H2O;
故答案为:2mol;2mol;Cl2+2OH-=Cl-+ClO-+H2O;2、16、10、2、5、8H2O.
点评:本题考查了气体的制备实验、氧化还原反应配平、物质的量的有关计算等,题目难度中等,注意掌握常用氧化还原反应的配平方法.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案
相关题目
下列关于物质分类的说法正确的是( )
| A、醋酸、氨水、硫酸钡均属于弱电解质、 |
| B、铜合金、铝合金、钢铁均属于金属材料 |
| C、动物油、植物油、矿物油均属于酯类化合物 |
| D、稀豆浆、稀盐酸、硅胶均属于胶体 |
在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A、某溶液中:Ca2+、H+、Cl-、HSO3- |
| B、能使PH试纸呈红色的溶液:Na+、NH4+、Fe2+、NO3- |
| C、Na2CO3溶液:K+、Fe3+、SO42-、NO3- |
| D、Kw/c(H+)=0.1mol/L的溶液:Na+、K+、S2-、NO3- |
下列关于第②步和第③步的说法,正确的是( )
| A、加入H2O2的主要作用是将溶液中的Fe2+氧化为Fe3+ |
| B、CuSO4?5H2O和Al2(SO4)3?18H2O均属于混合物 |
| C、实验室中过滤时可直接将滤液倒入有滤纸的漏斗中 |
| D、高锰酸钾溶液也可以氧化Fe2+,所以第②步中可以用酸性高锰酸钾溶液代替H2O2 |
 尿黑酸症是由酪氨酸在人体内非正常代谢而产生的一种疾病.酪氨酸结构简式如图所示,下列关于酪氨酸的说法不正确的是( )
尿黑酸症是由酪氨酸在人体内非正常代谢而产生的一种疾病.酪氨酸结构简式如图所示,下列关于酪氨酸的说法不正确的是( )| A、酪氨酸的分子式为C9HllNO3 |
| B、酪氨酸能发生缩聚反应生成高分子化合物 |
| C、酪氨酸能与溴水发生取代反应 |
| D、1mol酪氨酸能和2 molNaHCO3反应 |